
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция 1. Основным элементом, входящим в состав органических соединений, является углерод
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ.
Основным элементом, входящим в состав органических соединений, является углерод. Поэтому Бутлеров определил органическую химию как химию соединений углерода. Однако существуют простые вещества, содержащие углерод (СО2, СО, НСN и ее соли и др.) которые относят к неорганическим соединениям. Поэтому, органическую химию следует определять как химию углеводородов и их производных в состав которых могут входить почти все элементы периодической системы.
Выделение органической химии в самостоятельный раздел химической науки вызвано рядом причин.
Первая связана с многочисленностью органических соединений, в настоящее время их известно около 10 млн., а неорганических – около 600 тыс.
Вторая заключается в сложности и своеобразии органических веществ, по сравнению с неорганическими соединениями. Основной причиной многообразия органических соединений является способность атома углерода соединяться не только с другими атомами, но и друг с другом, образуя прямые, разветвленные и замкнутые углеродные цепи. Температуры плавления и кипения органических соединений ниже, чем неорганических, они легко разрушаются при сравнительно невысоких температурах, по сравнению с неорганическими соединениями. Большинство химических реакций органических соединений протекает гораздо медленней, чем ионные реакции, характерные для неорганических соединений, что обусловлено природой основной химической связи в органических соединениях – ковалентной связи. Кроме того, в органической химии появляются новые понятия и явления: органический радикал, функциональная группа, изомерия, гомологи, взаимное влияние атомов и групп атомов в молекуле и др.
Третья причина выделения органической химии в отдельную науку заключается в том, что многие органические вещества играют исключительно важную роль для человека, так как они находят разносторонне практическое применение (лекарственные препараты, полимерные материалы, искусственные ткани и каучуки, органические красители и т.д.). Кроме того, органическая химия изучает вещества, многие их которых непосредственно связаны с процессами жизнедеятельности животных и растительных организмов, например, такие как белки и нуклеиновые кислоты, ответственные, в том числе за передачу генетической информации.
Однако, провести резкую грань между органической и неорганической химией нельзя, поскольку обе подчиняются одним и тем же законам природы. При этом необходимо помнить, что органическая химия – наука о более высокой форме организации материи. В этом ее отличительная особенность.
В 1828 году Веллер, нагревая раствор ционата аммония, получил мочевину – органическое вещество, являющееся продуктом жизнедеятельности живого организма:
NH4CNO → H2N─CO─NH2
Ф. Энгельс по этому поводу писал, что благодаря получению неорганическим путем таких химических соединений, которые до того времени порождались только в живом организме, было доказано, что законы химии имеют ту же силу для органических тел, что и для неорганических. С того времени началось крушение существовавшей до этого виталистической теории Берцелиуса, утверждавшей, что в «живой природе элементы повинуются иным законам, чем в безжизненной», и что органические вещества могут получаться только под воздействием особой «жизненной силы».
Особенно быстро начинает развиваться органическая химия с 60-х годов XIX века, когда А.М.Бутлеров создал теорию химического строения органических соединений, ставшую научной основой для дальнейшего развития исследований в этой области химии. В начале прошлого века на базе важнейших исследований по органической химии, связанных с именами выдающихся российских ученых А.М. Бутлерова, Н.Н.Зинина, В.В.Морковникова, Е.Е.Вагнера, Н.Д.Зелинского, А.Ф.Фаворского, С.В.Лебедева и др., была создана нефте- и газоперерабатывающая промышленность, началось производство пластмасс, искусственных волокон и синтетических каучуков. Стала развиваться химия красителей, лекарственных веществ, витаминов и моющих средств. В наши дни без органической химии нельзя представить машиностроение, самолетостроение, транспорт, электротехническую промышленность сельское хозяйство и медицину. Незаменимы в строительной индустрии пластмассы, полимерцементы и полимербетоны, клеи и герметики, кремнийорганические соединения, поверхностно-активные вещества, полимерные красители и другие продукты.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ В ОРГАНИЧЕСКОЙ ХИМИИ.
1.Доструктурные теории. Накопление большого экспериментального материала в органической химии потребовало создания теории, объясняющей наблюдаемые факты.
Первой теорией была «теория радикалов» (Берцелиус, Либих, Веллер, Гей-Люссак). В основе этой теории было принято понятие об «органическом радикале» - группе из нескольких атомов, которая может переходить без изменения из одной молекулы (исходное вещество) в другую (продукт реакции). Поскольку Берцелиус рассматривал органические вещества как системы, состоящие из органического радикала (с положительным зарядом) и простого неорганического остатка (заряженного отрицательно), связанных с помощью электростатического взаимодействия, теория радикалов известна еще и как дуалистическая теория (от лат. duos – два). Сторонники этой теории рассматривала радикал как абсолютно устойчивую и неизменяемую часть молекулы. Это основная ошибка теории.
В 40-х годах XIX века возникла другая теория – «теория типов» (Жерар, Лоран, Дюма). В противоположность «теории радикалов» она рассматривала масть молекулы, изменяющуюся в ходе химической реакции. Согласно этой теории все известные в то время органические вещества были отнесены по характеру их химических превращений к пяти типам:
Н Н Н Н Н
O Н Н
Н Сl H N C
H H
H H
водорода хлороводорода воды аммиака углерода
При замене атома водорода в любом из этих типов на радикал можно получить различные органические соединения. Однако с развитием органической химии накопление фактических данных уже не укладывалось в известные типы. Сложилась критическая ситуация для этой теории. Выход из этого мог быть только в создании новой теории.
Для появления новой теории были созданы некоторые предпосылки. Было установлено, что углерод проявляет валентность равную четырем (Кекуле, Кольбе), и что его атомы способны соединяться друг с другом в длинные цепи. Была также предложена (Купер) система изображения отдельных связей с помощью черточек-символов.
Теория химического строения органических соединений А.М.Бутлерова.
Основная идея этой теории была сформулирована Бутлеровым 1861 г в статье «О химическом строении вещества». Сущность этой теории можно кратко сформулировать в виде следующих положений.
1. Атомы, входящие в состав молекулы органического вещества, не находятся в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями (согласно валентности этих атомов). Последовательность соединения атомов в молекуле Бутлеров назвал химическим строением.
2. От строения молекул, т.е. от того, в каком порядке соединены между собой атомы в молекуле, зависят свойства вещества.
3. Зная свойства вещества, можно установить его строение, и наоборот: химическое строение может много сказать о его свойствах.
4. Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние наблюдается в случае, если они связаны друг с другом непосредственно.
5. Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной.
В процессе создания теории строения Бутлеров пришел к мысли, что органические соединения должны иметь пространственное строение. Это было вызвано в первую очередь тем, что некоторые виды изомерии (геометрическая и оптическая) трудно было объяснить с точки зрения плоского строения молекул. Эта догадка была подтверждена Вант-Гоффом и Ле-Белем, независимо выдвинувшими идею о тетраэдрической направленности связей атома углерода.
Сегодня сущность этой теории можно выразить следующим образом:
физические и химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
Изображение органических соединений с помощью структурных формул.
Изображения органических соединений с помощью символов и черточек для обозначения химических связей называют структурными формулами. Например:
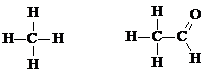
Простая связь (σ-связь) обозначается одной черточкой, двойная – двумя, тройная – тремя. Число черточек у элемента соответствует его валентности. Обычно структурные формулы записывают в более сокращенном виде:
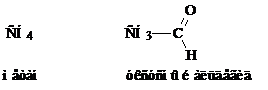
При изображении циклических соединений начертания символов углерода и водорода вообще опускают, а их присутствие при этом подразумевается.
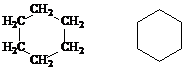
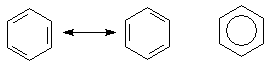
Циклогексан бензол
Нельзя забывать, что любая даже очень удачная структурная формула – это всего лишь абстрактный образ молекулы. Она является отображением реальной структуры и выражением свойств органической молекулы.
Электронное строение атомов. Квантовая механика (М.Планк, Л.де Бройль, Э.Шредингер, В.Гейзенберг) изучает движение и энергетическое состояние микрочастиц. Согласно этой теории электрон в атоме обладает двойственной природой: ему приписываются свойства как частицы, так и волны (квантово-волновой дуализм). Движение электрона в поле ядра описывается уравнением Э.Шредингера (1926), которое устанавливает соотношение между полной энергией электрона и волновой функцией ψ, характеризующей его состояние в атоме.
Квадрат этой функции ψ2 представляет собой вероятность нахождения электрона в определенной точке пространства вокруг ядра, т.е. ψ2 является мерой электронной плотности в данной точке пространства. Такое пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется электронным облаком или орбиталью. Состояние электрона и характер его орбиталей характеризуется четырьмя квантовыми числами, которые вводятся как параметры при решении уравнения Шредингера: главным n, орбитальным l, магнитным ml и спиновым ms.
Главное квантовое число n определяет расстояние орбитали от ядра атома, а значит, и энергию электрона – энергетический уровень орбитали, на котором находится электрон. Энергетический уровень (электронный слой) – совокупность электронов в атоме, имеющих одинаковое значение n. Увеличение главного квантового числа n ведет к возрастанию энергии электрона. Число n может изменяться от 1 до значения, соответствующего номеру периода в котором находится данный элемент. Энергетические уровни (1, 2, 3 и т.д.) обозначают также латинскими заглавными буквами K, L, M и т.д.
Орбитальное квантовое число l определяет форму (симметрию) орбиталей и связано с моментом импульса движущегося электрона. Оно может принимать целочисленные значения от 0 до n – 1. При n = 1 число l = 1, n = 2, l = 0 и 1. Орбитальное квантовое число определяет число подуровней каждого энергетического уровня. На одном подуровне расположены электроны с одинаковым значением n и l. Для обозначения подуровней используются строчные буквы латинского алфавита – s, p, d и f, поэтому атомные орбитали на соответствующих подуровнях также подразделяют на типы: s, p, d и f. Электроны, образующие s-подуровень, называют s-электронами, р-подуровень,
р – электронами.
Магнитное квантовое число ml определяет пространственную ориентацию орбитали, а также число орбиталей на соответствующем подуровне. Оно изменяется в пределах от – l до + l, включая нуль, т.е. может принимать 2l + 1 значений. При l = 0 ml также равно нулю; в этом случае возможна только одна 1s орбиталь, имеющая форму сферы, в центре которой расположено ядро атома. Орбиталь 1s имеет меньшую по сравнению с другими орбиталями энергию. Орбиталь 2s представляет собой также сферу с ядром в центре, но по размерам больше 1s-орбитали. Она имеет и более высокую энергию. Если l = 1, то ml = –1, 0, +1; при таких значениях ml возможны три гантелеобразных 2р-орбитали, направленные по трем взаимно перпендикулярным осям координат (x, y, z) и обозначаемые как 2рх, 2рy, 2pz. Они обладают равной энергией. Таким образом, для s-подуровня возможна одна 1s (или 2s)-орбиталь, для р-подуровня – три 2р-орбитали.
Спиновое квантовое число ms обусловлено наличием у электрона собственного момента импульса. Оно соответствует двум возможным ориентациям магнитного момента электрона в магнитном поле и имеет два значения: +1/2 и –1/2 (вдоль силовых линий или против.)
Согласно принципу В.Паули (1925) в атоме не может быть электронов с одинаковым набором всех четырех квантовых чисел. Это означает, что на одной орбитали могут находиться электроны с антипараллельными спинами (ms = +1/2 и –1/2), но с одинаковыми значениями n, l, ml. Такие электроны называют спаренными (неподеленная электронная пара). Их обычно условно изображают в виде двух противоположно направленных стрелок, помещенных в квадрат (квадрат – условное обозначение атомной орбитали).
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа № 1 | | | Лекция 2. Электронное строение атома углерода, типы гибридизации орбиталей |
Дата добавления: 2014-10-14; просмотров: 370; Нарушение авторских прав

Мы поможем в написании ваших работ!