
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция 2. Электронное строение атома углерода, типы гибридизации орбиталей
Электронное строение атома углерода, типы гибридизации орбиталей.
Углерод – первый элемент IV группы периодической системы элементов. Два его электрона находятся на внутреннем К-уровне, а на внешнем L-уровне, – четыре электрона.
В основном состоянии К- и L-уровни у атома углерода имеют строение
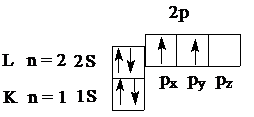
или 1s22s22p2 (1s22s22px2py)
Такое распределение электронов может привести к неверному выводу о том, что углерод является двухвалентным элементом. Действительно, во втором наружном слое спарены только 2s-электрона, а не спарены 2р-электрона и они способны образовывать химические связи. Однако валентность углерода равна 4, и это объясняется тем, что в момент химической реакции атом углерода может переходить из основного состояния (1s22s22p2) в возбужденное (условно обозначается С*). При этом происходит распаривание 2s электронов и переход одного их них на свободную 2pz-орбиталь:
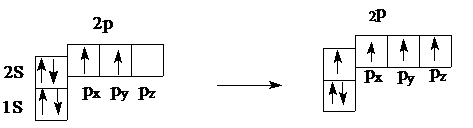
или 1s22s22p3 (1s22s22px2py2pz)
В результате такого перехода образуются четыре неспаренных электрона – один 2s и три 2p. Это возможно потому, что энергия 2s и 2p уровней отличается не очень сильно (676,2 кДж/моль), что затем с избытком компенсируется образованием дополнительно двух связей (412 кДж/моль х 2). При этом можно ошибочно предположить, что в молекуле метана имеется разные связи: одна s–s-связь и три s–p-связи, которые должны отличаться по энергии и направленности. Однако из эксперимента известно, что в метане все связи одинаковы. Для объяснения этого факта было введено понятие о гибридизацци (смешении) орбиталей (Л.Полинг, Ж.Слейтер, 1931). Было показано, что электроны в молекулах, как правило, располагаются не на «чистых» s-и p-орбиталях, а на смешанных – гибридных. Такие орбитали полнее перекрываются с орбиталями других атомов, образуя более прочные связи. Этому способствует форма гибридных орбиталей. В пространстве они располагаются на максимальном удалении друг от друга и обладают одинаковой энергией.
Для атома углерода возможны три валентных состояния с различными типами гибридизации.
sp3-Гибридизация. При этом происходит смешение одной 2s и трех 2p-орбиталей. В результате образуется четыре одинаковые гибридные орбитали, имеющие бóльшую электронную плотность по одну сторону ядра. Поэтому каждая из гибридных орбиталей способна в большей степени перекрываться с орбиталями других атомов, чем отдельные «чистые» 2s- и 2р-орбитали.
Все четыре гибридные орбитали строго ориентированы в пространстве, создавая своими «лепестками» тетраэдр, так как они расположены относительно друг-друга под углом 109о 28´.
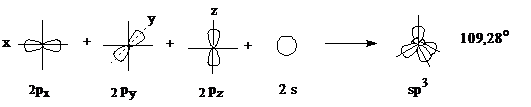
Такая геометрия обеспечивает минимальное отталкивание между четырьмя связывающими парами электронов при углероде в молекуле метана.
Состояние углеродного атома с sp3-гибридными орбиталями часто называют первым валентным состоянием. Оно характерно для предельных углеводородов.
sp2-Гибридизация. Эта гибридизация – результат смешения одной 2s- и двух 2р-орбиталей. При этом образуются три гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
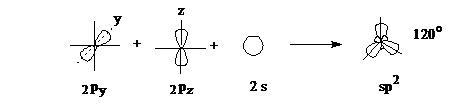
Третья 2р-орбиталь располагается в плоскости, перпендикулярной плоскости гибридных орбиталей и участвует в образовании двойной связи за счет бокового перекрывания (π-связь). Этот тип перекрывания характерен для непредельных углеводородов ряда этилена и называется вторым валентным состоянием.
sр-Гибридизация. При смешении 2s- и 2р-орбиталей образуются две гибридные орбитали, расположенные на одной прямой линии.
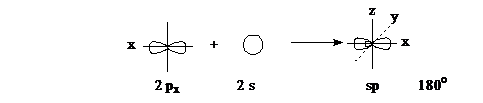
Оставшиеся две 2р-орбитали не принимают участия в гибридизации, расположены во взаимно перпендикулярных плоскостях и за счет бокового перекрывания образуют π-связи тройной связи (непредельные углеводороды ряда ацетилена). Этот тип гибридизации третье валентное состояние углерода.
Гибридизация – это способ объяснить экспериментальные результаты определения углов, длин и энергии различных связей, обусловленные характером электронных орбиталей и их взаимодействием.
Природа и типы химической связи. Основные типы химической связи – ионная и ковалентная.
Ионная связь (электровалентная, гетерополярная). С помощью этой связи построено большинство неорганических соединений. Эта связь возникает между атомами, которые сильно отличаются по электроотрицательности. Процесс образования связи состоит в передаче электрона от одного атома к другому. Образовавшаяся при этом электронная пара перемещается к одному из соединяющихся атомов – возникают два противоположно заряженных иона, с устойчивыми электронными оболочками (октетами), характерными для инертных газов, которые удерживаются друг с другом за счет электростатического взаимодействия. Схематически это можно представить так:
Na· + ·Cl → [ Na ]+ + [ Cl ]¯
Ионная связь имеет свои особенности. Она отличается значительной полярностью, а вещества с такой связью имеют высокую температуру плавления и кипения, хорошей растворимостью в полярных растворителях, электропроводностью растворов и большой скоростью протекания химических реакций с участием ионов.
Ковалентная (гомеополярная) связь. При образовании связи между атомами, электроотрицательности которых равны или отличаются незначительно, передачи электрона от одного атома к другому не происходит.
В этом случае связь образуется за счет обобществления неспаренных электронов (двух, четырех или шести), принадлежавших обоим атомам до образования химической связи. Каждая из этих электронных пар образует только одну ковалентную связь, обозначаемую черточкой:
Cl· + Cl· → Cl : Cl или Cl – Cl
Ковалентная связь – наиболее распространенный тип химической связи в органической химии. Она образуется при перекрывании орбиталей реагирующих атомов с образованием устойчивых электронных оболочек – октетов, а не путем отдачи – присоединения как в случае ионной связи.
Ковалентная связь моде быть простой (одинарной), двойной и тройной.
Связь между атомами, осуществляемая парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов называют простой (одинарной) или σ (сигма) -связью.
Такая связь может быть образована при перекрывании как s-, так и 2р-электронов, а также электронов, находящихся в sp3-, sp2- и sp-гибридизации. При перекрывании двух 2р-орбиталей σ-связь образуется при условии осевого перекрывания.
В предельных углеводородах, в которых атом углерода находится в sp3-гибрином состоянии, имеются только σ-связи
Если в образовании ковалентной связи принимают участие две или три электронные пары, то такую химическую связь называют кратной. Она может быть двойной (в случае двух пар электронов) или тройной (с участием трех пар электронов.
Кратные связи состоят из одной σ-связи и одной или двух π(пи)-связей. В этом случае σ-связь образована в результате перекрывания sp2-гибридных орбиталей, а π-связь – негибридизованных 2р-орбиталей. Электроны, принимающие участие в образовании π-связи, обычно называют π-электронами.
Двойная углерод-углеродная связь характерна этиленовых углеводородов, а тройная – для ацетиленовых.
Ковалентная связь характеризуется полярностью, поляризуемостью, направленностью, длиной и энергией.
Если в образовании ковалентной связи участвуют атомы с различным сродством к электрону (электрооттрицательностью), то электронная пара связи будет смещена в сторону атома с бóльшей электроотрицательностью и такая ковалентная связь будет полярной. Например в формуле
СН3δ+– Сlδ–
знаки δ+ и δ– означают, что на атоме хлора имеется избыточная электронная плотность (частичный отрицательный заряд), а на атоме углерода – недостаток электронной плотности (частичный положительный заряд). Смещение электронной плотности в молекуле можно также показать стрелкой:
СН3→Сl
Полярность связи может быть количественно охарактеризована с помощью электрических дипольных моментов. Электрический момент диполя (μ = er) является векторной величиной и измеряется в кулон-метрах (Кл·м) или дебаях D (1D = 3,34.10-30 Кл . м).
Поляризуемость связи – способность изменять полярность под воздействием внешнего электромагнитного поля. Такое поле может создавать и атакующий реагент, и растворитель.
Направленность ковалентной связи – основное ее отличие от других видов связи. Направленность означает, что ее образование происходит только в опрделенных напрвлениях пространства.Углы, которые образуют ковалентные связи между собой, связаны с валентныс состоянием углерода. При sp3-гибридизации угол между гибридными орбиталями состаляет 109°28', sp2-гибридизации он равен 120°, а при sp-гибридизации – 180°.
Длина ковалентной связи определяется как расстояние между ядрами, выраженное в нанометрах (1 нм = 10-9 м). Длина связи зависит от ее характера:
чем больше кратность, тем она короче (С–С 0,154 нм; С=С 0,134 нм; С≡С 0,120 нм).
Энергия связи определяется как среднее значение энергий диссоциации связей до нейтральных атомов (А–В → А· + В·, энергия С–С связи 334,7 кДж/моль, С–Н – 414,2 кДж/моль.)
Координационная связь – частный случай ковалентной связи. Такая связь возникает, когда один их атомов имеет неподеленную электронную пару, а другой – вакантную орбиталь. У последнего до октета не хватает двух или более электронов. В этом случае происходит обобществление неподеленной пары электронов с образованием связи:
Н3N: + H+ → NH4+ (ион аммония).
Атом, обладающий неподеленной электронной парой и предоставляющий их для образования новой химической связи, называют донором, А который их принимает – акцептором. Поэтому, такую связь называют донорно-акцепторной.
Разновидностью координационной связи является семиполярная связь. Эта связь осуществляется также за счет неподеленной пары одного из атомов. Отдавая эту пару для образования связи, атом приобретает положительный заряд, а у другого атома, принявшего эту пару, появляется отрицательный заряд.
В результате новую связь можно рассматривать как одновременное проявление двух видов связи ковалентной (за счет обобществления электронной пары) и ионной за счет взаимодействия противоположных зарядов. Например:
(СН3)3 N: + O: → (CH3)3N+– O– или (СН3)3N→O
триметиламин оксид триметиламина
Водородная связь (Н-связь). Такая связь возникает между атомами, имеющими свободную электронную пару (например, кислород, азот, сера и др.), и водородом, который связан с другим атомом высокополярной ковалентной связью (например О–Н). В этом случае водород обладает достаточно высокой подвижностью, в результате чего возникает связь особого типа (Н-связь) энергия которой составляет всего 12,5 – 21 кДж/моль.
Водородная связь играет огромную роль в живой природе. Вода входящая в состав животных и растительных организмов, образует водородные связи, которые во много определяют их свойства.
Водородная связь образуется во многих системах, используемых в качестве строительных растворов и вяжущих материалов. Играет большую роль в процессах крашения, приготовлении некоторых полимерных материалов.
| <== предыдущая страница | | | следующая страница ==> |
| Лекция 1. Основным элементом, входящим в состав органических соединений, является углерод | | |
Дата добавления: 2014-10-14; просмотров: 493; Нарушение авторских прав

Мы поможем в написании ваших работ!