
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Возможность самопроизвольного прохождения
химических реакций. Энергия Гиббса
Вопрос о возможности самопроизвольного прохождения реакций относится к числу наиболее важных в химии. Опыт показывает, что при низких температурах самопроизвольно проходят преимущественно экзотермические реакции, но наблюдаются и самопроизвольные эндотермические процессы, например растворение большинства солей в воде. При повышенных температурах чаще реализуются эндотермические процессы, сопровождающиеся увеличением энтропии системы.
Таким образом, наблюдаются две противоположные тенденции:
1) стремление системы перейти в состояние с наименьшей внутренней энергией (с выделением её части), характеризуется изменением энтальпии системы;
2) стремление к беспорядку, характеризуется изменением энтропии системы.
Сопоставление этих двух противоположных тенденций дает возможность определить направление самопроизвольного прохождения процесса при заданных условиях. Величины 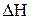 и
и 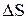 в термодинамике связаны соотношением
в термодинамике связаны соотношением
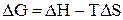 при
при 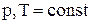 ,
,
в котором D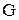 - энергия Гиббса, термодинамическая функция, имеющая математическое определение:
- энергия Гиббса, термодинамическая функция, имеющая математическое определение: 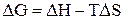 . Размерность энергии Гиббса - кДж/моль.
. Размерность энергии Гиббса - кДж/моль.
В системах, находящихся при постоянной температуре и давлении, самопроизвольно могут протекать процессы, сопровождающиеся уменьшением энергии Гиббса. Изменение энергии Гиббса, таким образом, характеризует направление самопроизвольного протекания процессов, в том числе химических реакций.
· Если DG <0, самопроизвольно может идти прямая реакция;
если DG>0, самопроизвольно не может идти прямая реакция;
если DG = 0, система находится в состоянии химического равновесия.
· Пример. Оцените возможность прохождения в стандартных условиях реакции С(ГРАФИТ) + 1/2О2(Г) Û СО(Г), DН0 = 86 кДж/моль; DS0 = 88 Дж/(моль · К).
Решение. Рассчитываем стандартную энергию Гиббса химической реакции
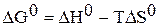 =
= 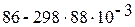 = 59 кДж/моль.
= 59 кДж/моль.
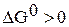 , следовательно, в стандартных условиях реакция самопроизвольно проходить не может.
, следовательно, в стандартных условиях реакция самопроизвольно проходить не может.
Оценим влияние температуры на возможность прохождения данной реакции. Если пренебречь зависимостями величин 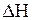 и
и 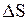 от температуры и считать их постоянными, можно рассчитать энергию Гиббса химической реакции при нестандартной температуре T:
от температуры и считать их постоянными, можно рассчитать энергию Гиббса химической реакции при нестандартной температуре T:
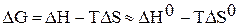 .
.
Уравнению 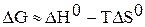 соответствует прямая в координатах
соответствует прямая в координатах 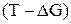 .
.
Сравним с уравнением прямой 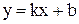 в координатах
в координатах 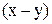 :
:
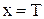 ,
, 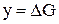 ,
, 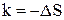 ,
, 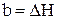 .
.
Найдём точку пересечения прямой с осью абсцисс, т.е. температуру, при которой 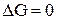 :
:
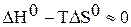 ;
; 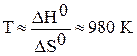 .
.
Построим график, из которого видно, что в интервале температур 0 – 980 К 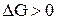 , следовательно, прямая реакция самопроизвольно идти не может, выше 980 К
, следовательно, прямая реакция самопроизвольно идти не может, выше 980 К 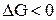 энергия Гиббса <0, т.е. самопроизвольно может идти прямая реакция.
энергия Гиббса <0, т.е. самопроизвольно может идти прямая реакция.
 DG, кДж/моль
DG, кДж/моль
 86
86

-90 980 T, K
4. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
| <== предыдущая страница | | | следующая страница ==> |
| Энтропия | | |
Дата добавления: 2014-02-27; просмотров: 477; Нарушение авторских прав

Мы поможем в написании ваших работ!