
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химическое равновесие
В природе существуют реакции практически необратимые (идущие в одном направлении) и обратимые реакции (идущие в прямом и обратном направлениях). Пример необратимой реакции: 2KClO3 = 2KCl + 3O2, обратимой реакции: 2SO2 + O2 Û 2SO3. Большинство реакций обратимы, в уравнениях таких реакций ставят знак обратимости (стрелки в двух направлениях Û).
Если в какой-либо замкнутой системе может идти обратимая реакция, то наступит такой момент, когда скорости прямой и обратной реакций станут одинаковыми.
· Состояние системы, характеризующееся равными скоростями прямой и обратной реакций, называют состоянием химического равновесия.
Химическое равновесие имеет динамический характер. Это означает, что количество любого вещества, расходующегося в ходе прямой реакции, равно его количеству, образующемуся в результате обратной реакции. В условиях химического равновесия концентрации всех веществ в системе не изменяются со временем, их называют равновесными концентрациями. Равновесные концентрации обозначают символом вещества в квадратных скобках: 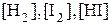 .
.
Рассмотрим состояние химического равновесия в системе H2 + I2 Û 2HI при 450 0С, когда иод находится в парообразном состоянии. Реакцию, идущую слева направо, называют прямой, а справа налево - обратной. При химическом равновесии скорость прямой реакции равна скорости обратной реакции: 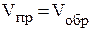 . Кинетические уравнения для прямой и обратной реакций в данной системе согласуются с законом действующих масс, следовательно,
. Кинетические уравнения для прямой и обратной реакций в данной системе согласуются с законом действующих масс, следовательно,
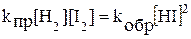 .
.
После преобразования получим:
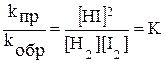 .
.
Постоянную величину 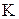 называют константой химического равновесия. Она зависит от природы реагирующих веществ и температуры, но не зависит от концентраций веществ. В общем виде для системы
называют константой химического равновесия. Она зависит от природы реагирующих веществ и температуры, но не зависит от концентраций веществ. В общем виде для системы
aA + bB Û cC + dD
| <== предыдущая страница | | | следующая страница ==> |
| | | Выражение константы равновесия имеет вид |
Дата добавления: 2014-02-27; просмотров: 325; Нарушение авторских прав

Мы поможем в написании ваших работ!