
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа №8.Определение жесткости воды и ее умягчение
Цель работы. Познакомиться с методами определения и способамиустранения жесткости воды.
Оборудование и реактивы:
Теоретическая часть:
Большее влияние на качество воды оказывают содержащиеся вней соли кальция, магния и железа(П), которые и обуславливаютжесткость воды.
Природная вода, проходя через известковые горные породы ипочвы, обогащается солями кальция и магния и становится жесткой.Нерастворимые карбонаты металлов под действием углекислогогаза и воды переходят в растворимые гидрокарбонаты и растворяютсяв грунтовых водах:
МеСО3↓+СО2+Н2О=Ме(НСО3)2
Жесткая вода непригодна для многих технологических процессов. Нерастворимые соли кальция и магния осаждаются на внутренних стенках паровых котлов и трубопроводов, образуя слой накипи, который плохо проводит теплоту. Это вызывает перерасход топлива и преждевременный износ котлов. В результате перегрева котлов могут происходить аварии. В жесткой воде значительно быстрее протекает процесс коррозии. В жесткой воде при стирке белья увеличивается расход мыла (мыло - натриевая или калиевая соль высших карбоновых кислот), так как образуется осадок стеарата кальция и магния:
Этим и объясняется незначительное пенообразование и снижение моющего действия мыла. Калиевые соли по сравнению с натриевыми солями лучше растворимы в воде и поэтому обладают более сильными моющими свойствами. При стирке белья жесткая вода ухудшает качество тканей. Ткань, впитывая нерастворимые соли, желтеет и быстро ветшает.
Жесткость воды бывает двух видов: временная и постоянная. Временная или карбонатная жесткость воды (Жк) обусловлена присутствием в воде гидрокарбонатов кальция, магния и железа: Са(НСО3)2, Мg(НСО3)2, Fe(НСО3)2.
Постоянная или некарбонатная жесткость воды (Жнк) обусловлена содержанием в воде сульфатов, хлоридов, нитратов и других растворимых солей кальция и мания: СаSO4, МgSO4, СаCl2 и др. Общая жесткость воды (Жо) равна сумме карбонатной и некарбонатной жесткости:
Жо=Жк+Жнк
Количественно жесткость воды определяется суммой молярных концентраций эквивалентов ионов кальция имагния, выраженных в миллимоль на литр (моль/л)
Ж= 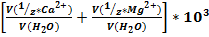
Ж= 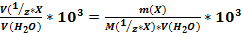
Где v( 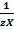 ) – количество вещества эквивалента ионов кальция или магния (или их солей), моль;
) – количество вещества эквивалента ионов кальция или магния (или их солей), моль;
M(Х) – масса ионов кальция или магния (или их солей), г/моль; М( 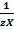 ) – молярная масса эквивалента ионов кальция или магния (или их солей), г/моль; V (Н2О) – объем воды, л.
) – молярная масса эквивалента ионов кальция или магния (или их солей), г/моль; V (Н2О) – объем воды, л.
По величине жесткости природную воду делят на :
Очень мягкую – до 1,5 ммоль/л;
Мягкую – от 1,5 до 4 ммоль/л;
Средней жестксти – от 4 до 8 моль/л;
жесткую – от 8 до 12 ммоль/л;
Очень жесткую – свыше 12 ммоль/л.
По нормам СанПиН 2.1.4.1074-01 жесткость воды должна быть не более 7 мг-экв/л. Даже при небольшой жесткости 4 мг-экв/л в системе водоснабжения и на сантехнике накапливается осадок в больших количествах. Жесткая вода негативно сказывается на здоровье человека, на работе сантехнического и котельного оборудования. Поэтому чтобы не испортить оборудование требуется умягчение воды. При повышенной жесткости воды в котлах и бойлерах умягчение воды обязательно. В разных странах разная классификация, в зависимости от жесткости воды:
| Жесткость воды в мг. экв | Справочник по гидрохимии | Водоподготовка | Германия DIN 19643 | USEPA |
| 0 – 1.5 | Мягкая вода | Очень мягкая | Мягкая | Мягкая |
| 1.5 - 1.6 | Мягкая | Умеренно жесткая | ||
| 1.6 – 2.4 | Средней жесткости | |||
| 2.4 – 3.0 | Достаточно жесткая | |||
| 3.0 – 3.6 | Умеренно жесткая | Жесткая | ||
| 3.6 – 4.0 | Жесткая | |||
| 4.0 – 6.0 | Средней жесткости | |||
| 6.0 – 8.0 | Жесткая | Очень Жесткая | Очень Жесткая | |
| 8.0 – 9.0 | Жесткая | |||
| 9.0 – 12.0 | Очень жесткая | |||
| Свыше 12.0 | Очень Жесткая |
Жесткость воды хозяйственно-питьевых водопроводов в России не должна превышать 7 ммоль/л. Для использования воды в хозяйственных целях ее подвергают умягчению. Существет несколько разных видов умягчения воды:
· Термическое умягчение воды, основано на нагревании воды, дистилляции и вымораживании.
· Реагентное умягчение воды, при этом способе очистки воды ионы Ca+2 и Mg+2 связываются различными веществами в нерастворимые соединения.
· Ионный обмен – очистка воды фильтрованием через катионообменные смолы, которые обменивают ионы натрия Na+ (или водорода H+) на ионы Ca+2 и Mg+2.
· Электромагнитное воздействие на воду.
· Диализ.
· Умягчение воды на установках обратного осмоса и нанофильтрации
Самый простой способ борьбы с карбонатной жесткостью - прокипятить воду. При этом гидрокарбонат кальция распадается с выделением углекислого газа и выпадением в осадок карбоната кальция. Этот процесс мы можем наблюдать при кипячении воды в чайнике. В промышленности термический способ применяют при наличии дарового тепла. Пи кипячении гидрокарбонаты металлов могут разрушатся, образуя трудно растворимые вещества:
Ме(НСО3) =МеСО3↓+ СО2↑+ Н2О
При кипячении жесткость воды уменьшается на величину карбонатной жесткости, поэтому карбонатную жесткость называют временной.
Реагентные методы наиболее распространены на станциях муниципальной водоподготовки и сводятся к переводу солей кальция в нерастворимые соединения, выпадающие в осадок. В зависимости от состава воды прибавляют соду(устраняют некарбонатную жесткость), гашеную известь(карбонатную жесткость) или и то, и другое.. При одновременном добавлении известии соды можно избавиться от карбонатной и некарбонатной жесткости.
Са(НСО3)+Са(ОН)2=2 СаСО3+Н2О
СаСl2+Na2CO3=CaCO3+2NaCl
Наиболее распространенными и передовыми считаются на данный момент – ионный обмен, обратный осмос и нанофильтрация.
При небольших превышениях жесткости воды и сухого остатка в воде, применяют натрий – катионитовую смолу или другие разновидности ионообменных смол. При прохождении жесткой воды через катионообменную смолу происходит обмен катионов Ca+2 и Mg+2 на катионы Na+, которые входят в состав смолы, таким образом, катионы Ca+2 и Mg+2 остаются на смоле, а катионы Na+ переходят в умягчаемую воду. Со временем все катионы Na+ обмениваются на катионы жесткости, катионообменная смола теряет способность умягчать воду и ее необходимо регенерировать. Для этого смола промывается раствором поваренной соли NaCl, в результате чего происходит процесс, обратный умягчению: катионы натрия переходят в состав смолы, при этом вытесняя катионы кальция и магния в промывную воду, сливаемую в дренаж (канализацию). После этого обогащенная натрием смола становиться вновь готовой к умягчению.
Экспериментальная часть:
Опты 1. Определение общей жесткости воды
Общую жесткость воды (Ж0) определяют комплексонометрическим методом. Этот метод основан на способности двухзамещенной натриевой соли этилендиаминтетрауксусной кислоты (комплексона или трилона Б):
Для определения общей жесткости воду титруют раствором трилона Б в присутствии индикатора (кислотный хромтемносиний или эриохромчерный). В точке эквивалентности при титровании индикатор изменяет окраску розовую (в присутствии ионов жесткости -Са2+ и Mg2+) на синюю (в отсутствии этих ионов).
Комплексообразование ионов кальция и магния с трилоном Б происходит в щелочной среде (рН ~ 10), поэтому при выполнении работы используют буферный раствор.
Буферными называют растворы, содержащие слабую кислоту и ее соль (СН3СООН + NaCH3COO) или слабое основание и его соль (NH4OH + NH4Cl). Такие растворы сохраняют постоянную концентрацию ионов водорода, или рН раствора, как при разбавлении, так и при добавлении небольших количеств сильных кислот и или щелочей,т.е. оказывают буферное действие.
1. В две конические колбы влейте по 100 мл жесткой (или водопроводной) воды, отмеренной с помощью мерной колбы.
2. Добавьте к исследуемой воде по 5 мл. аммиачного буферного раствора и 3-5 кристалликов эриохома черного и перемешайте.
3. Бюретку заполните Трилоном Б, предварительно промойте ее тем же раствором.
4. Оттитруйте воду раствором трилона Б до перехода розовой окраски в сине-сиреневый цвет.
5. Измерьте объем трилона Б, пошедший на титрование данной порции воды, результат запишите в таблицу.
6. Если результаты титрования совпадают, то рассчитайте общую жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найдите среднее знаечние объема трилона и по закону эквивалентов рассчитайте общую жесткость воды (моль/л):
Жо= 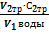 х103
х103
Где V1-объем анализируемой воды, мл;
V2-объем растворатрилона Б, мл;
С2-молярная концентрация эквивалента раствора трилона Б, моль/л;
103- коэффициент перевода моль/л в моль/л
Таблица 1. Результаты определения общей жесткости воды
| Номер опыта | Объем раствора трилона Б, V2,мл | Молярная концентрация эквивалента трилона Б, С2,моль/л | Объем исследуемой пробы воды, V1,мл | Общая жесткость воды, Ж0,моль/л |
Опыт 2. Определение карбонатной и некарбонатной жесткостиводы
Карбонатную жесткость воды (Жк) определяют титрованиемисследуемой воды раствором соляной кислоты. При этом растворенныев воде гидрокарбонаты количественно реагируют с солянойкислотой по уравнению
Ме(НСО3)2+2НСl=МеСl2+2СО2+2Н2О
1. В две конические колбы с помощью мерного цилиндра отмерьте по 100 мл водопроводной воды.
2. Добавьте к исследуемой воде 2-3 капли раствора индикатора метилового оранжевого. Метиловый оранжевый изменяет свою окраску от красной при рН<3,1 до желтой при рН>4,4. В точке перехода метиловый оранжевый имеет оранжевую окраску. Анион НСО3- в воде гидролизуется:
НСО3-+Н2О=Н2СО3+ОН-
Поэтомувода, содержащая гидрокарбонаты кальция и магния, имеет щелочную рекцию среды. Добавленный к воде метиловый оранжевый окрашивает ее в желтый цвет. При титровании исследуемой воды раствором соляной кислоты протекает реакция нейтрализации:
ОН- +Н+ =Н2О
Количество ионов ОН- эквивалентно концентрации ионов НСО3-, а следовательно, и концентрации гидрокарбонатов кальция и магния.
3. Оттитруйте подготовленную пробу раствором соляной кислоты известной концентрации до тех пор, пока раствор неприобретет оранжевую окраску, но не розовую.
4. Результаты титрования запишите.
5. Оттитруйте исследуемую воду во второй колбе. Если результаты двух исследований совпадут, то вычислите карбонатную жесткость воды.
6. Если результаты двух титрований не совпадают, то оттитруйте еще одну или две пробы воды.
Карбонатную или временную жесткость воды (ммоль/л) рассчитайте, используя закон эквивалентов
Жк= 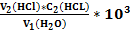
Где V1-объем анализируемой воды, мл;
V2-объем раствора соляной кислоты, мл;
С2- молярная концентрация эквивалента или молярная концентрация раствора соляной кислоты, моль/л;
103 –коэффициент перевода моль/л в ммоль/л. Некарбонатную жесткость воды (Жнк) определяют по разности результатов:
Жнк=Жо-Жк
Результаты опыта сведите в таблицу 2:
Таблица 2. Экспериментальные данные определения раличных видов жесткости воды
| Номер опыта | Объем исследуемой пробы, мл | Объем раствора соляной кислоты, V2,мл | Молярная концентрация соляной кислоты, С2,моль/л | Жесткость воды | ||
| Карбонатная Жк, ммоль\л | Некарбонатная Жнк, ммоль\л | Общая Жо, ммоль\л | ||||
| 1 | ||||||
| 2 | ||||||
| 3 |
Опыт 3. Реагентное умягчение воды
Проведите умягчение воды с помощью карбоната натрия. Количество веществасодыберется в избытке против эквивалентногопо жесткости на 1 ммоль/л. Поэтому количество реагента, необходимогодля умягчения 100 мл воды, рассчитывается таким образом:
ν(соли)= 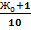 ммоль/л
ммоль/л
Для проведения эксперимента используется раствор солей с молярнойконцентрацией эквивалента, равной 0,03 моль/л, следовательно,объем раствора соли, необходимый для умягчения исследуемойпробы воды, будет равен:
V(раствора)= 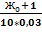 мл
мл
1. К 100 мл исследуемой воды прилейте рассчитанный объем растворакарбоната натрия, нагрейте на электроплитке с асбестированной сеткой до 40-50 °С.
2. Затем раствор охладите и отфильтруйте.
3. Фильтр предварительно трижды промойте дистиллированной водойнад раковиной. Пробу отфильтруйте в коническую колбу. Фильтрпромойте один раз дистиллированной водой и присоедините этуводу к фильтрату. Затем определите общую жесткость, как это описанов опыте ранее.
4. Результаты опытавнесите в таблицу 3.
Таблица 3. Результаты умягчения воды реагентным способом
| Объем исследуемой пробы, V1,мл | Объем раствора трилона Б, V2,мл | Молярная конентрация эквивалента трилона Б, С2,моль/л | Общая жесткость воды | |
| После умягчения, моль/л | До умягчения, моль/л | |||
Вопросы к защите:
1. Что называют жесткостью воды? Почему жесткость воды следует устранять?
2. Каким образом в природе может образовываться жесткая вода?
3. Какие виды жесткой воды различают?
4. Чем обуславливается временная и постоянная жесткость воды?
5. Какие способы устранения жесткости воды могут использоваться?
6. Какой метод умягчения воды называют термическим? Какие
химические реакции протекают при умягчении воды этим методом?
7. В чем суть реагентного метода умягчения воды? Какие реагентыпри этом могут быть использованы? Какие реакции протекают?
8. Можно ли умягчать воду с помощью ионного обмена? Какимобразом?
9. Почему жесткость, обусловленная присутствием в воде гидрокарбонатов
кальция и магния, называется временной? Какиереакции будут происходить: а) при кипячении воды, содержащей гидрокарбонат кальция; б) при добавлении к ней соды; в)при добавлении к ней гидроксида натрия?
10. Как определяют общую, карбонатную и некарбонатную жесткостьводы?
11. В 10 л воды содержится 136 мг сульфата кальция и 190 мг хлоридамагния. Чему равна жесткость этой воды?
ПРИЛОЖЕНИЕ
Таблица 2.
Плотности водных растворов некоторых веществ при 20оС
| NaCl | H2SO4 | HCl | CH3COOH | ||||
| w | r, г/л | w | r, г/л | w | r, г/л | w | r, г/л |
| 0,01 | 1005,3 | 0,003 | 1000,0 | 0,004 | 1000,0 | 0,04 | 1004,1 |
| 0,02 | 1012,5 | 0,032 | 1020,0 | 0,024 | 1010,0 | 0,08 | 1009,8 |
| 0,04 | 1026,8 | 0,062 | 1040,0 | 0,044 | 1020,0 | 0,12 | 1015,4 |
| 0,06 | 1041,3 | 0,091 | 1060,0 | 0,064 | 1030,0 | 0,16 | 1020,8 |
| 0,08 | 1055,9 | 0,120 | 1080,0 | 0,085 | 1040,0 | 0,20 | 1026,1 |
| 0,10 | 1070,7 | 0,147 | 1100,0 | 0,105 | 1050,0 | 0,24 | 1031,2 |
| 0,12 | 1085,7 | 0,174 | 1120,0 | 0,125 | 1060,0 | 0,28 | 1036,0 |
| 0,14 | 1100,9 | 0,201 | 1140,0 | 0,145 | 1070,0 | 0,32 | 1040,5 |
| 0,16 | 1116,2 | 0,227 | 1160,0 | 0,165 | 1080,0 | 0,36 | 1044,8 |
| 0,18 | 1131,9 | 0,252 | 1180,0 | 0,184 | 1090,0 | 0,40 | 1048,8 |
| 0,20 | 1147,8 | 0,277 | 1200,0 | 0,204 | 1100,0 | 0,44 | 1052,5 |
| 0,22 | 1164,0 | 0,302 | 1220,0 | 0,223 | 1110,0 | 0,48 | 1055,9 |
| 0,24 | 1180,4 | 0,326 | 1240,0 | 0,243 | 1120,0 | 0,52 | 1059,0 |
| 0,26 | 1197,2 | 0,350 | 1260,0 | 0,262 | 1130,0 | 0,56 | 1061,8 |
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа №7.Качественный анализ | | |
Дата добавления: 2014-11-15; просмотров: 1053; Нарушение авторских прав

Мы поможем в написании ваших работ!