
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Анализ термодинамических процессов идеального газа
2.1. Задачи анализа и общие аналитические зависимости.
Задачей анализа любого термодинамического процесса является установление закономерностей изменения параметров состояния рабочего тела и выявление особенностей превращения энергии.
С этой целью производится анализ процесса в следующем порядке:
1. Выводится уравнение процесса в 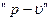 - координатах;
- координатах;
2. Устанавливается зависимость между изменяющимися термодинамическимипараметрами в процессе;
3. Определяется изменение внутренней энергии - Δu;
4. Определяется работа расширения рабочего тела – l;
5. Определяется внешняя теплота – q, необходимая для протекания рабочего процесса;
6. Определяется изменение энтальпии - Δi и изменение энтропии – Δs между начальным и конечным состоянием рабочего тела;
7. Строится графическое изображение процесса в 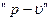 и
и 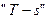 - координатах.
- координатах.
Полученные таким образомданные позволяют рассмотреть особенности превращения энергии впроцессе, составить схему энергобаланса.
Из всего многообразия возможных процессов выделяются процессы, протекающие при постоянном значении одного из параметров состояния рабочего тела. Они носят название основных термодинамических процессов. К ним относится: процесс, протекающий при постоянном объеме – изохорный; процесс, протекающий при постоянном давлении - изобарный; процесс, протекающий при постоянной температуре – изотермический; процесс, протекающий без теплообмена с окружающей средой - адиабатный. Адиабатный процесс является изоэнтропным, то есть процессом, протекающим при постоянном значении энтропии рабочего тела.
Внутренняя энергия и энтальпия являются функциями состояния рабочего тела, и, следовательно, изменение внутренней энергии и энтальпии не зависит от характера процесса, а зависит только от начального и конечного состояния рабочего тела. Вследствие этого можно получить расчетные зависимости для определения их изменений, которые будут справедливы для любых термодинамических процессов идеального газа. Это достигается при применении первого закона термодинамики к изохорному и изобарному процессам.
В изохорном процессе (υ=const) изменение объема равно нулю (dυ=0), и, следовательно, работа расширения рабочего тела также обращается в нуль. Отсюда при 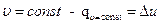 , в свою очередь количество теплоты в изохорном процессе равно -
, в свою очередь количество теплоты в изохорном процессе равно - 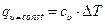 (при
(при 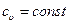 ), следовательно, изменение внутренней энергии в изохорном процессе, а значит и во всех процессах идеального газа, определяется зависимостью
), следовательно, изменение внутренней энергии в изохорном процессе, а значит и во всех процессах идеального газа, определяется зависимостью
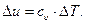
Аналогично, для изобарного процесса (р= const) изменение давления равно нулю (dp = 0). Воспользовавшись второй формой записи первого закона термодинамики - 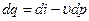 , получаем, что в изобарном процессе
, получаем, что в изобарном процессе 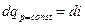
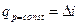 . В свою очередь
. В свою очередь 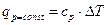 (при
(при 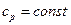 ), следовательно, изменение энтальпии в изобарном процессе и во всех процессах идеального газа определяется зависимостью
), следовательно, изменение энтальпии в изобарном процессе и во всех процессах идеального газа определяется зависимостью  .
.
Таким образом, выражения 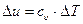 и
и 
 или
или  и
и 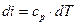 являются общими для определения изменения внутренней энергии и энтальпии в любом процессе идеального газа.
являются общими для определения изменения внутренней энергии и энтальпии в любом процессе идеального газа.
Для определения изменения энтропии в процессах идеального газа можно получить общие зависимости из термодинамического тождества
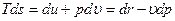
(термодинамическое тождество получается при совместном рассмотрении выражения первого закона термодинамики - 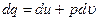 и второго закона термодинамики -
и второго закона термодинамики - 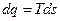 ).
).
Из термодинамического тождества получаем:
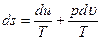 .
.
С учетом того, что 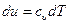 и
и  , получаем
, получаем
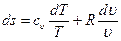 .
.
Интегрируя это дифференциальное уравнение, получим общее выражение для изменения энтропии в процессах идеального газа:
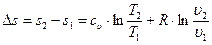 .
.
Аналогичным образом можно получить выражение
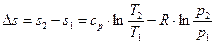 ,
,
Исходным уравнением, для которого является запись термодинамического тождества в виде - 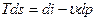 .
.
2.2. Изохорный процесс  .
.
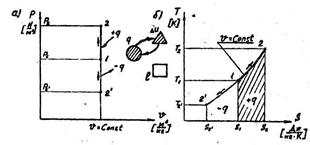 В «р – υ» - координатах график процесса представляет собой прямую линию - рис. 2.1 (а)
В «р – υ» - координатах график процесса представляет собой прямую линию - рис. 2.1 (а)
Рис. 2.1. Изображение изохорного процесса:
а) в «р – υ» - координатах;
б) в «Т-s» - координатах.
Изохорный процесс может протекать с повышением давления - при подводе теплоты и с понижением давления - при отводе теплоты. Зависимость между параметрами состояния в изохорном процессе имеет вид
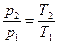 .
.
Изменение энтальпии в изохорном процессе 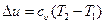 при
при 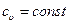 . В изохорном процессе (
. В изохорном процессе ( 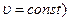 изменение объема равно нулю
изменение объема равно нулю 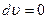 и работа расширения газа не совершается -
и работа расширения газа не совершается - 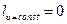 , поэтому вся теплота, участвующая в процессе, расходуется только на изменение внутренней энергии:
, поэтому вся теплота, участвующая в процессе, расходуется только на изменение внутренней энергии:
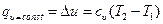 , при
, при 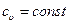 .
.
Изменение энтальпии в изохорном процессе 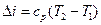 при
при 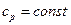 . Изменение энтропии в изохорном процессе с учетом того, что
. Изменение энтропии в изохорном процессе с учетом того, что 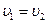 , может быть определено зависимостью
, может быть определено зависимостью
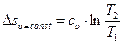 ,
,
либо
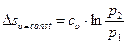
В «T – s» - координатах изохорный процесс изображается кривой 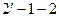 - рис.2.1. (б).
- рис.2.1. (б).
Схема энергобаланса для изохорного процесса показана на рис.2.1. Доля теплоты, идущая на изменение внутренней энергии в изохорном процессе, равна – 1:
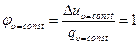 .
.
| <== предыдущая страница | | | следующая страница ==> |
| Назначение и выбор системы терморегулирования | | | АРХИТЕКТУРНЫЕ ЧЕРТЕЖИ |
Дата добавления: 2014-11-15; просмотров: 857; Нарушение авторских прав

Мы поможем в написании ваших работ!