
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Критическое состояние вещества
Концентрация молекул (или плотность) насыщенного пара растут с повышением температуры, а плотность жидкого конденсированного состояния вещества, находящегося в равновесии со своим паром, убывает с повышением температуры – вещество расширяется (n0 с повышением температуры убывает!). Убывающая и возрастающая величины плотностей обязаны при определенной температуре стать равными друг другу. Выше этой температуры не существует границ раздела «конденсированное жидкое–газообразное». Эта температура называется критической.
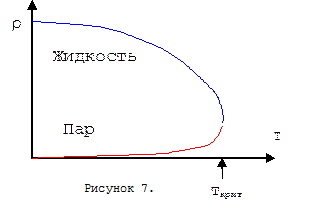
На рисунке 7 приведены качественные зависимости плотности жидкости и плотности насыщенного пара для этого же вещества от температуры.
Критическое состояние характеризуется не только температурой, но также давлением и плотностью вещества. Критические давления всех веществ на два – три порядка больше атмосферного давления. ([9])
Для большинства простых веществ отношение плотности в критическом состоянии к плотности в твердом или жидком состоянии при низкой температуре и атмосферном давлении лежат в узком диапазоне 0,3 – 0,4. Исключение составляют гелий (0,57), щелочные металлы (для них это отношение находится в диапазоне 0,21 – 0,23), а также сера – (0,10) и фосфор – (0,08).
Отношение величины RTкрит к теплоте парообразования при атмосферном давлении (за вычетом работы против сил атмосферного давления) для большинства простых веществ лежит в узком диапазоне 0,17 – 0,23. Исключение составляют: гелий (0,87) и водород (0,37) ([10]), а также щелочные металлы (0,26 – 0,29), и снова сера (0,127) и фосфор (0,064) ([11]).
Среднее расстояние между центрами соседних атомов (молекул) в критическом состоянии Lкр больше, чем соответствующие расстояния в конденсированном состоянии при низкой температуре. Отношение Lкр/D равно: 1,5 – 1,36. Располагаясь ровно посередине между своими ближайшими соседями-молекулами, находящимися на расстоянии 2Lкр, выделенная молекула находится в потенциальной яме, глубина которой примерно равна kTкрит. А располагаясь в непосредственной близости от любой из соседок, выделенная молекула попадает в потенциальную яму, глубина которой в несколько раз больше, чем kTкрит.
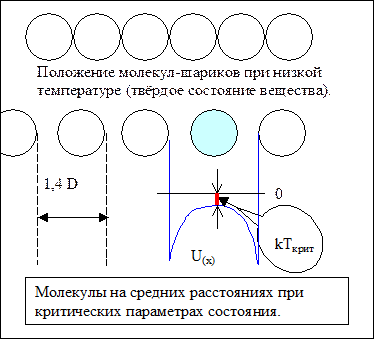
На рисунке в нижней части приведено расположение нескольких шариков-молекул (мгновенная фотография) для очень редкого события, когда они все друг от друга находятся на одинаковых расстояниях, соответствующих средней плотности вещества. Отмечено на рисунке и среднее расстояние между центрами молекул 1,4D. Синяя линия изображает зависимость потенциальной энергии выделенной голубым цветом молекулы от её положения по отношению к соседним молекулам. Поскольку каждая молекула в среднем по времени для данного направления (X,Y,Z) имеет кинетическую энергию, равную kT/2, то это означает, что большую часть времени каждая молекула проводит вблизи одной (или нескольких) из своих соседок. Выходит, что в критическом состоянии молекулы объединяются в группы и часто переходят из одной группы в другую, а не располагаются на средних расстояниях Lкр друг от друга. Возможность перегруппировки молекул при образовании объединений из большого числа молекул и хаотическое распределение кластеров из молекул по пространству приводят к появлению у вещества в критическом состоянии интересного свойства. Локальная плотность в малом объеме имеет значительные флуктуации. Вещество при критических параметрах «не сопротивляется» изменению его объема. Уравнение В-д-В показывает, что в критической точке равны нулю первая и вторая производная от давления по объему при постоянной температуре. В критическом состоянии наблюдается интересное явление: критическая опалесценция вещества.
Отмеченные узкие диапазоны отношений соответствующих физических величин для большинства простых веществ демонстрируют общность поведения многих веществ в тепловых процессах. Это «объясняется» уравнением В-д-В. Очевидно, что Ван-дер-Ваальс получил Нобелевскую премию заслуженно, так как открыл простые закономерности в огромном экспериментальном материале о тепловых свойствах веществ. Его открытие в физике сродни тому, что сделал Д.И. Менделеев в химии.
[1] Выведите их самостоятельно! Это достаточно просто.
[2] Можно назвать эту величину «критической» температурой, хотя это название уже зарезервировано для критического состояния вещества.
[3] Формальное математическое определение кривизны гладкой поверхности в выбранной точке здесь не приводится. Численно она равна сумме двух обратных радиусов кривизны линий, получающихся при пересечении данной поверхности двумя взаимно перпендикулярными плоскостями. Эти плоскости перпендикулярны также касательной плоскости к данной точке кривой поверхности и проходят через выбранную точку.
[4] Кстати, идея о наличии «запрещенного» объема имеется уже в кинетической модели газов и используется для получения уравнения Ван-дер-Ваальса.
[5] Разрыв происходит, если растягивающее давление достигает значительной величины. Для некоторых веществ это растягивающее (разрывное) давление составляет до 0,4 Pint.
[6] Характерная для каждого вещества температура, выше которой это вещество достаточно хорошо описывается классическими законами, а при температурах более низких – для описания свойств вещества нужно использовать квантовую механику.
[7] Конечно, эти два случая расположения молекул служат только для иллюстрации рассказа, а на самом деле существует несколько типов различающихся кристаллических решеток, которые описывают расположение атомов или молекул в составе твердого тела.
[8] Плавление для некоторых веществ сопровождается уменьшением объема – это соответствует тому, что в материале вещества происходит перестройка его структуры, тоже приводящая к уменьшению собственного давления вещества. Это имеет место, например, для перехода лёд – жидкая вода.
[9] За исключением гелия, для которого критическое давление всего в два раза больше атмосферного.
[10] Это вещества, для которых при критических условиях проявляются квантовые свойства.
[11] Эксперименты показывают, что в насыщенном паре разных веществ, в том числе и в парах щелочных металлов, в значительных количествах присутствуют объединения, состоящие из нескольких атомов. Это похоже на образование многоатомных молекул. При некоторых числах объединенных атомов концентрации соответствующих объединений гораздо выше, чем для других чисел.
| <== предыдущая страница | | | следующая страница ==> |
| Переход жидкость – пар | | | ЖИЛИЩНОЕ ПРАВО |
Дата добавления: 2014-11-20; просмотров: 452; Нарушение авторских прав

Мы поможем в написании ваших работ!