
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАКОН КОЛЬРАУША
Рассмотрим зависимость эквивалентной электропроводности раствора электролита от скорости движения ионов. Пусть электрический ток проходит через раствор электролита, помещенный в стеклянную трубку с поперечным сечением S см2, причем расстояние между электродами равно l см и разность потенциалов между ними равна Е в. Обозначим через v+* и v-* скорости движения катионов и анионов см/с, а через Cэ -концентрацию раствора электролита г-экв/л. Если степень диссоциации электролита в данном растворе равна a, то концентрации катионов и анионов равны
a г-экв/см3. Подсчитаем количество электричества, которое переносится через поперечное сечение трубки за 1 с. Катионов за это время пройдет через сечение v+*Saг-экв и они перенесут v+*SaCэ кулонов электричества, так как 1 г-экв переносит количество электричества, равное числу Фарадея.
Анионы в обратном направлении перенесут v-*SaCэF/1000 кулонов электричества. Сила тока I ,т.е. общее количество электричества, проходящее через данное поперечное сечение раствора в 1 с, равна сумме количеств электричества, переносимого ионами в обоих направлениях.
I = (v+* + v-*) SaCэ.
Скорость движения ионов v+* и v-* прямо пропорциональна напряженности поля E/l,
v+* = v+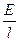 ;
;
v-* = v-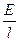 ,
,
где v+ и v- абсолютные скорости ионов.
Абсолютной скоростью движения иона называется его скорость, отнесенная к градиенту потенциала в 1 в/ см.
Получим
I = 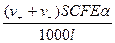 ,
,
так как
I = 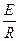 ;
;
R = 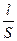 ;
;
æ = 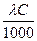 ;
;
I = Eæ;
I = 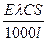 .
.
Приравнивая правые части уравнений, получим
l = aF(v+ + v-) .
Для сильных электролитов a = 1 и
l = F(v+ + v-).
Произведения Fv+ = l+ и Fv- = l- - называются подвижностями, или электропроводностями ионов.
Для слабых электролитов
l = a(l+ + l-),
для сильных
l = l+ + l-.
Для предельно разбавленного раствора
l¥ = l+¥ + l-¥,
где l+¥ и l-¥ -подвижности, или электропроводности ионов при предельном разбавлении.
Это уравнение справедливо как для сильных, так и для слабых электролитов, выражает собой закон Кольрауша, согласно которому эквивалентная электропроводность при предельном разведении равна сумме подвижностей при предельном разведении
7.2.3 ЗАВИСИМОСТЬ ЭЛЕКТРОПРОВОДНОСТИ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ ОТ КОНЦЕНТРАЦИИ ЭЛЕКТРОЛИТА
Эквивалентная электропроводность растворов электролитов зависит от двух факторов: от степени диссоциации электролита и от электростатического взаимодействия между ионами. С увеличением концентрации электролита в растворе уменьшается степень диссоциации и увеличивается электростатическое взаимодействие между ионами. Это приводит к уменьшению эквивалентной электропроводности.
Выведем общее выражение зависимости эквивалентной электропроводности раствора любого электролита от его концентрации.
Разделив l = aF(v+ + v-) на l¥ = F(v+¥ + v-¥),
получим l = afll¥ ,
где l¥ -эквивалентная электропроводность при бесконечном разведении;
fl -коэффициент электропроводности.
fl = 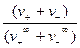 ,
,
где v+¥ v-¥ -абсолютные скорости ионов при предельном разбавлении.
В разбавленных растворах слабых электролитов электростатическое взаимодействие между ионами мало, поэтому
v+ + v- = v+¥ + v-¥ ,
и, следовательно fl =1.
Тогда для разбавленных растворов слабых электролитов
l = afll¥;
a = 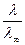 .
.
Выразим зависимость эквивалентной электропроводности слабого электролита от концентрации. Для этого, согласно закону действующих масс, найдем соотношение между концентрацией и степенью диссоциации для одно-одновалентного электролита.
Константу равновесия слабого одно-одновалентного электролита выражают уравнением
К = 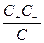 ;
;
С+ = С- = aС;
К = 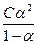 ;
;
a2С + aК – К = 0;
a = 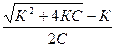 ,
,
и при малых значениях a, когда 1 - a = 1;
a = 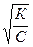 .
.
Из этих уравнений получаем зависимость эквивалентной электропроводности разбавленных растворов одно-одновалентных электролитов от концентрации электролита
l = (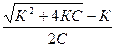 )l¥;
)l¥;
l = 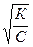 l¥.
l¥.
С увеличением концентрации эквивалентная электропроводность резко падает
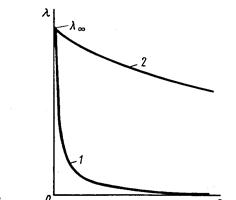
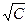
1 – слабые электролиты
2 – сильные электролиты.
В концентрированных растворах слабых электролитов нужно учитывать также коэффициент электропроводности и коэффициенты активности ионов электролита. Для сильных электролитов a = 1 и поэтому имеем
l = fll¥.
Таким образом, в растворе сильных электролитов изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности, т.е. влиянием электростатического взаимодействия ионов на скорость их движения.
Эквивалентная электропроводность сильного электролита сравнительно медленно меняется с концентрацией электролита.
Это объясняется тем, что коэффициент электропроводности в растворе сильного электролита меняется с концентрацией слабее, чем степень диссоциации в растворе слабого электролита с его концентрацией.
Рассмотрим зависимость удельной электропроводности раствора сильного электролита от концентрации. Она имеет вид
æ = 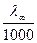 (Сfl).
(Сfl).
Это уравнение носит сложный характер. В разбавленных растворах fl = 1 и удельная электропроводность увеличивается почти пропорционально концентрации. Но в более концентрированных растворах fl уменьшается. Если fl уменьшается быстрее, чем растет C, то удельная электропроводность имеет максимальное значение.
На основе электростатической теории сильных электролитов Дебай, Гюккель и Онзагер получили выражение для эквивалентной электропроводности предельно разбавленных растворов сильных электролитов. Изменение эквивалентной электропроводности растворов сильных электролитов с концентрацией электролита объясняется торможением движения ионов в электрическом поле из-за их электростатического взаимодействия. С увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает. При этом учитываются два эффекта, вызывающих электростатическое взаимное торможение ионов: электрофоретический и релаксационный эффекты.
Электрофоретический эффект заключается в том, что движение ионов какого-либо знака происходит в среде ионов другого знака, перемещающейся в противоположном направлении. Возникающая при этом вследствие взаимного притяжения сила трения будет пропорциональна скорости движения. Уменьшение электропроводности должно быть пропорционально электрофоретической силе трения.
Релаксационный эффект связан с существованием ионной атмосферы и ее влиянием на движение ионов. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь воссоздается в новом положении. Образование и разрушение ионной атмосферы протекает с большой, но конечной скоростью, характеристикой которой служит время релаксации. Время релаксации зависит от ионной силы раствора, его вязкости и диэлектрической проницаемости.
Расчеты показывают, что ионная атмосфера воссоздается не мгновенно. Следовательно, при движении центрального иона под действием электрического поля заряд ионной атмосферы позади него больше, чем впереди. Возникающие при этом электрические силы притяжения тормозят движение иона.
Если изменение эквивалентной электропроводности, связанной с электрофоретическим эффектом, обозначить через Dl1 ,а с релаксационным эффектом через Dl2 ,то электропроводность при концентрации С выразится уравнением
l = l¥ - (Dl1 + Dl2).
Дебай и Гюккель получили выражение для Dl1 и Dl2 :
l = l¥ - (аl¥ + b)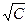 .
.
Для сильных электролитов значение l¥ определяется обычно линейной экстраполяцией опытных кривых, выраженных в координатах l - 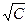 до значений - С = 0. Для слабых электролитов значения l¥, вычисленные непосредственно по опытным данным, получаются неточными, так как в разбавленных растворах электропроводность слабых электролитов меняется очень резко. Поэтому значения l¥ растворов слабых электролитов рассчитываются обычно по значениям l+¥ и l-¥, найденным по опытным значениям электропроводности сильных электролитов.
до значений - С = 0. Для слабых электролитов значения l¥, вычисленные непосредственно по опытным данным, получаются неточными, так как в разбавленных растворах электропроводность слабых электролитов меняется очень резко. Поэтому значения l¥ растворов слабых электролитов рассчитываются обычно по значениям l+¥ и l-¥, найденным по опытным значениям электропроводности сильных электролитов.
| <== предыдущая страница | | | следующая страница ==> |
| УДЕЛЬНАЯ И ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТИ | | | ПОДВИЖНОСТЬ И ЧИСЛА ПЕРЕНОСА ИОНОВ |
Дата добавления: 2014-03-11; просмотров: 833; Нарушение авторских прав

Мы поможем в написании ваших работ!