
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПОДВИЖНОСТЬ И ЧИСЛА ПЕРЕНОСА ИОНОВ
В растворе электролита ионы движутся беспорядочно. При наложении на раствор электрического поля беспорядочное движение ионов в основном сохраняется, но одно из направлений становится преимущественным. Направленность движения ионов можно создать при помощи электродов, опущенных в раствор. Чем выше градиент потенциала, т.е. чем больше падение напряжения на 1 см раствора электролита вдоль направления электрического поля, тем выше скорость движения иона в электрическом поле Самыми высокими скоростями обладают ионы Н3 О+ и ОН-
Н3О+ + Н2О 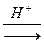 Н2О + Н3О+ ;
Н2О + Н3О+ ;
Н2О + ОН- 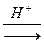 ОН- + Н2О.
ОН- + Н2О.
Причем средняя продолжительность существования иона Н3О+ =10-11 сек Переносчиками тока в растворах электролитов служат ионы, но так как абсолютные скорости движения анионов и катионов в данном растворе неодинаковы, то большую долю тока всегда переносят более быстрые ионы. Величину, при помощи которой можно выразить долю электричества, переносимую ионами данного вида, называют числом переноса; для катионов оно обозначается t+ и для анионов через t-. Количество электричества, перенесенное ионами i-того вида через данное сечение раствора электролита, определяется по уравнению
qi = ziFCiviS,
где zi_-валентность, Сi- концентрация, vi- абсолютная скорость ионов i -того вида, S - площадь сечения, t- время.
Число переноса ti определяется соотношением
ti = 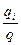 ,
,
где q - количество электричества, перенесенное всеми ионами. На основании этой формулы можно сказать, что число переноса - это доля электричества, перенесенная ионами данного вида.
В частности, для раствора сильного электролита можно записать
t+ = 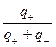 ;
;
t- = 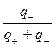 .
.
Подставив предыдущие выражения, получим
t+ = 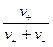 ;
;
t- = 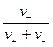 ,
,
при этом t+ + t- = 1.
Различие в скоростях движения анионов и катионов приводит к тому, что они переносят разные количества электричества, но это не влечет за собой нарушение электронейтральности раствора, а лишь изменяет концентрацию электролита у катода и анода.
Между числами переноса и подвижностями ионов в растворе сильных электролитов существует зависимость:
из уравнения l+ = Fv+ ;
l- = Fv- следует
t+ = 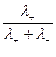 ;
;
t- = 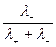 ;
;
l+ = lt+ ;
l- = lt-.
Числа переноса остаются практически постоянными до тех пор, пока концентрация сильного электролита не превышает 0,2 г-экв/л, при дальнейшем увеличении концентрации наблюдается их изменение.
С ростом температуры абсолютные скорости ионов и подвижности ионов увеличиваются, но не в одинаковой мере. Поэтому числа переноса с изменение температуры также меняются. При этом если число переноса катиона увеличивается, то числа переноса анионов уменьшаются и наоборот.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАКОН КОЛЬРАУША | | | ИЗМЕРЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ |
Дата добавления: 2014-03-11; просмотров: 659; Нарушение авторских прав

Мы поможем в написании ваших работ!