
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГОМОГЕННЫЙ КАТАЛИЗ
Главным положением теории гомогенного катализа является представление о том, что в ходе реакции образуются неустойчивые промежуточные соединения катализатора с peaгирующими веществами, которые затем распадаются с регенерацией катализатора.
В общем случае для реакции типа: А + В = Р образуется промежуточное соединение одного из реагентов с катализатором А + К = АК, затем это соединение взаимодействует с другим исходным веществом и дает продукты реакции и катализатор
АК+В ® Р+К.
При теоретическом рассмотрении кинетики гомогенных каталитических реакций часто предполагается, что промежуточные соединения находятся в равновесии с исходными веществами. Такие промежуточные соединения называют веществами Аррениуса. В этом случае схема реакции типа
А + В = Р запишется следующим образом:
А + К « АК;
АК + В ® Р + К.
Так как считается, что промежуточное соединение находится в равновесии с исходными веществами, то v1 = v2 .Отсюда, обозначая через сксуммарную концентрацию катализатора, получим
k1cA(cK – cAK) = k2cAK.
Найдем из этого уравнения концентрацию промежуточного соединения
cAK = 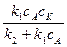 ;
;
и подставим в выражение скорости реакции (ввиду того, что продукты последней стадии одновременно являются продуктами суммарной реакции, скорость данной реакции равна скорости последней стадии):
v = k3cAKcB = 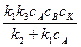 .
.
Уравнение указывает на существование двух предельных случаев:
1) если k1cA << k2, то v = 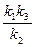 cAcBcK; 2) если k2 << k1cA то v = k3cBcK..
cAcBcK; 2) если k2 << k1cA то v = k3cBcK..
В обоих случаях скорость реакции прямо пропорциональна концентрации катализатора, как это обычно и бывает на практике. Суммарный порядок реакции по исходным веществам различен и принимает значение, равное единице или двум. Вне указанных предельных случаев порядок реакции дробный (1 < n < 2).
Промежуточные вещества, которые нельзя считать находящимися в равновесии с исходными веществами, называются веществами Вант-Гоффа. При рассмотрении кинетики реакций с промежуточными веществами Вант-Гоффа часто используется метод стационарных концентраций, т. е. предполагается, что концентрация промежуточного вещества с течением времени остается постоянной.
| <== предыдущая страница | | | следующая страница ==> |
| КАТАЛИТИЧЕСКИЕ РЕАКЦИИ | | | ОБОБЩЕННАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ. КИСЛОТНО-ОСНОВНЫЙ КАТАЛИЗ |
Дата добавления: 2014-03-11; просмотров: 351; Нарушение авторских прав

Мы поможем в написании ваших работ!