
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Гетерогенный катализ позволяет интенсифицировать производственные процессы, использовать более доступные и дешевые исходные материалы, получать новые вещества с нужными свойствами. В настоящее время гетерогенно-каталитические процессы используются в таких важнейших производствах, как получение серной кислоты, синтез аммиака, метанола, получение синтетического топлива, искусственного каучука, пластических масс и т. д.
Активность гетерогенных катализаторов зависит от физического или химического сродства катализатора к одному или нескольким реагентам. Действие катализатора сильно зависит от его физического состояния (плотный, порошкообразный и т. п.) и от присутствия посторонних веществ. Некоторые вещества, называемые промоторами, усиливают действие катализатора. Другие вещества, называемые каталитическими ядами, снижают активность катализатора, отравляют его (соединения серы, фосфора, свинца и мышьяка, а также ртуть, окись углерода и свободные галогены). Смесь катализаторов часто может действовать значительно сильнее по сравнению с действием отдельных катализаторов.
Большое значение имеет способ приготовления катализатора. Например, медный катализатор, приготовленный термическим разложением медных солей в неравновесных условиях, обладает значительной активностью в реакции гидратации спирта. В противоположность этому электролитическая и химически осажденная медь практически не являются катализаторами этой же реакции.
По представлениям Тейлора активность катализатора обеспечивается выступами и ребрами отдельных мельчайших кристаллов, имеющимися на всякой реальной поверхности твердого тела. Атомы, находящиеся на таких выступах, слабее связаны с другими атомами катализатора, обладают ненасыщенными валентностями и повышенной реакционной способностью. Поэтому выгоднее получать катализатор в условиях, способствующих образованию шероховатой и пористой поверхностей. С другой стороны (С. 3. Рогинский), реакционная способность катализатора зависит от его термодинамической неустойчивости. Катализаторы, полученные в неравновесных условиях, более активны. Самопроизвольную потерю активности катализаторов с течением времени - старение - можно объяснить постепенным переходом в более устойчивое состояние.
На практике часто применяются так называемые адсорбционные катализаторы, приготовленные путем нанесения катализатора на специальный носитель из неактивного материала (асбест, уголь, силикагель, пемза, фосфор и др.). Адсорбционные катализаторы позволяют достичь значительной экономии дорогостоящих веществ и, кроме высокой активности, обладают повышенной устойчивостью к нагреванию и действию ядов.
Изучение влияния ядов на каталитическую активность позволило получить важные сведения о природе катализаторов. Было замечено, что встречается как обратимое, так и необратимое отравление катализаторов. Так, железный катализатор, используемый в синтезе аммиака, обратимо отравляется кислородом. Пропускание над ним свежей смеси водорода с азотом снимает отравление и вновь делает катализатор активным. В присутствии серы этот же катализатор отравляется необратимо.
Для отравления катализатора требуется ничтожное количество яда. Поэтому возникло представление, что каталитически активной является не вся поверхность катализатора, а лишь некоторые ее участки - активные центры.Это подтверждается существованием катализаторов различной активности при одинаковой энергии активации. Например, при 200° С разложение муравьиной кислоты на стекле идет в 10 000 раз медленнее, чем на родии, хотя энергия активации в обоих случаях практически одинакова. Различие в скоростях реакций здесь можно объяснить неодинаковым количеством активных центров. То, что одно и то же вещество может быть ядом не для всех реакций, протекающих на данном катализаторе, говорит о неодинаковости активных центров для различных реакций. Действие промоторов, изменение температуры и других внешних условий влияет на количество и характер активных каталитических центров и изменяет, тем самым каталитическую активность катализатора.
. 9.5 СТАДИИ ГЕТЕРОГЕННЫХ КАТАЛИТИЧЕСКИХ ПРОЦЕССОВ. РОЛЬ АДСОРБЦИИ
В гетерогенно-каталитических реакциях, как и в других гетерогенных процессах, можно выделить ряд стадий. Наиболее обычными стадиями являются диффузия, обеспечивающая подвод исходных веществ к поверхности катализатора, адсорбция их на этой поверхности, взаимодействие адсорбированных веществ с образованием продуктов реакции, десорбция продуктов и, наконец, отвод продуктов реакции от поверхности катализатора в глубину соответствующей фазы с помощью диффузии. В зависимости от определяющей стадии реакция может протекать в диффузионной, кинетической или переходной областях. С изменением внешних условий роль определяющей стадии может перейти к другому процессу.
Адсорбцией называется процесс самопроизвольного концентрирования веществаиз объема фаз на поверхности раздела между ними. Адсорбция - вторая, после диффузии, стадия многих гетерогенных химических реакций. Ее роль особенно велика в каталитических процессах.
Различают физическую адсорбцию и хемосорбцию. При физической адсорбциимолекулы поглощаемого вещества (адсорбата) удерживаются поверхностью поглотителя (адсорбента) слабыми молекулярными силами притяжения
Физическая адсорбция увеличивается с ростом давления или концентрации поглощаемого вещества (адсорбата) и уменьшается при понижении концентрации. При хемосорбциив отличие от физической адсорбции молекулы поглощаемого вещества образуют поверхностное химическое соединение, при этом преодолевается обычно значительный энергетический барьер и адсорбция называется активированной. Поэтому хемосорбция данного вещества происходит лишь на некоторых «избранных» адсорбентах, в то время как физическая адсорбция возможна на любых поверхностях. Хемосорбция - обычно необратимый процесс. Опыты показали, что высокая каталитическая активность часто сопровождается значительной активированной адсорбцией. Величина адсорбции измеряется количеством молей адсорбата на 1 кг (или на 1 м2) адсорбента.
Ход реакции на поверхности катализатора с учетом стадий адсорбции и десорбции схематически показан на рисунке.
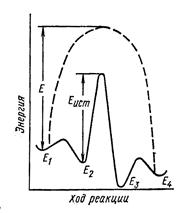
Энергия исходных реагентов Е1:после их адсорбции становится равной Е2. Затем происходит химическое превращение, преодолевается энергетический барьер и образуются продукты с энергией Е3, тоже находящиеся в адсорбированном состоянии. После десорбции продуктов энергия меняется и принимает значение Е4. На рисунке видно, что энергия активации даже наиболее затрудненной стадии Ек меньше энергии активации Ереакции, протекающей без катализатора, что при прочих равных условиях должно приводить к повышению скорости реакции. Величина Ек соответствует химической- реакции, протекающей на поверхности катализатора, и может быть названа истинной энергией активации.
| <== предыдущая страница | | | следующая страница ==> |
| ОБОБЩЕННАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ. КИСЛОТНО-ОСНОВНЫЙ КАТАЛИЗ | | | МУЛЬТИПЛЕТНАЯ ТЕОРИЯ |
Дата добавления: 2014-03-11; просмотров: 561; Нарушение авторских прав

Мы поможем в написании ваших работ!