
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Соединения и ионы, токсичные для бактерий
Полное отсутствие в среде токсических для организма веществ является событием, по всей видимости, крайне редким. Многие вещества могут быть полезными, безразличными или вредными в зависимости от их концентрации в среде и конкретных условий существования организма. Есть и вещества, например соли золота, урана, ртути и др., для бактерий не только бесполезные, но и угнетающие их даже в очень низких концентрациях.
Действие токсических для бактерий соединений может быть бактериостатическим или бактерицидным. Бактериостаз (греч. bacterion – палочка, stasis – стояние на месте) – задержка роста и размножения бактерий, вызванная действием неблагоприятных химических или физических факторов. Прекращение действия фактора приводит к возобнавлению роста и деления, хотя при длительном его воздействии может начаться гибель клеток, т.е. фактор проявляет бактерицидность (лат. caedere – убивать). Во многих случаях вещество в невысоких концентрациях обладает бактериостатическим, а в высоких бактерицидным действием. Присутствие в природных средах соединений, токсических для бактерий, приводит к уменьшению их видового разнообразия и появлению устойчивых форм.
Степень токсичности вещества для данной бактерии выражается через пороговую концентрацию, после достижения которой вещество становится бактерицидным, а также определяется его «концентрационной экспонентой» n. После достижения пороговой концентрации токсичного вещества наблюдается полулогарифмическая зависимость степени отмирания клеток бактерий от времени, log числа погибших клеток находится в линейной зависимости от времени воздействия. Концентрационная экспонента n рассчитывается по формуле:
n = 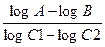 ,
,
где С1 – большая и С2 – меньшая концентрация вещества, А – время гибели определенной части клеток при концентрации С2, В – то же при концентрации С1.
Показатель n характеризует вещество, а не организм: n фенола 6, формальдегида и сулемы 1, этанола 9. Для фенола при n 6 разведение в 3 раза означает падение активности в 36, т.е. в 729 раз. Различия в чувствительности разных бактерий к определенному веществу зависят главным образом от значений их пороговых концентраций.
Антисептики (греч. anti – противо, septicos – гнилостный) – бактерициды, используемые в практической деятельности человека. Антисептики применяют в ветеринарии при лечении ран, для дезифекции, в пищевой промышленности для защиты продуктов от порчи, для предохранения от гниения деревянных сооружений и т.п. Очевидно, что для бактерий антисептики являются важными экологичесими факторами.
Бактерициды относятся к различным группам органичесикх и неорганических веществ. Это могут быть спирты, альдегиды, фенолы, жирные кислоты, галогеновые соединения, металлы и т. д. Механизмы действия бактерицидов разнообразны.
Высокотоксичны для бактерий сильные окислители, многие из которых используют в качестве антисептиков. Это перекись водорода, перманганат калия, галогены, озон, оксид этилена и др. Для обеззараживания питьевой воды широко применяют азон и хлор. Хлор гидролизуется в воде с образованием хлорноватистой кислоты НОCl, которая обладает сильными бактерицидными свойствами.
Повсеместно в настоящее время загрязнение среды отходами производств может неблагоприятно влиять и на развитие полезных бактерий. Одним из самых распространенных неорганических поллютантов, загрязнителей среды, является SO2 – сернистый газ. Это бесцветный газ, хорошо растворимый в воде, примесь продуктов сгорания топлива. После растворения он быстро гидратируется и превращается в сернистую кислоту, которая при диссоциации образует сульфитные и бисульфитные ионы:
SO + H2O 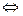 H2SO3
H2SO3 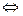 HSO3
HSO3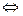 SO32-.
SO32-.
На равновесие между различными продуктами влияют рН, температура и ионная сила раствора. Наиболее токсично для бактерий недиссоциированная Н2SO3, но в этой форме она находится только при рН ниже 2,0. В диапазоне значений рН от 1,8 до 7,2, физиологических для большинства бактерий доминирует ион НSO3-. Последний может реагировать с альдегидными и кетонными группами гексоз и пентоз, по дисульфитным связям с белками, с НАД, ФМН, ФАД, иннактивирует иРНК, нарушает транспорт веществ, вызывает дезаминирование цитозина в ДНК, в присутствии аминов вызывает сшивки ДНК с белком.
При рН выше 9 присутствует только анион SO32-, для бактерий малотоксичный.
Катионные антисептики – это разнообразные соединения, в молекулах которых присутствуют сильноосновные группы, связанные с липофильными участками. Уже в невысоких концентрациях эти вещества нарушают функции мембран, в частности работу мембранного АТФазного комлекса. Хлоргексидин, относящийся к этой группе веществ, находят практическое применение в ветеринарии.
Бактериостатическим, а при высоких концентрациях бактерицидным действием обладают красители. Как уже упоминалось, многие красители при освещении обуславливают фотодинамический эффект, однако они могут быть эффективны и в отсутствии света. Чувствительность различных форм бактерий к определенным красителям может существенно различаться, поэтому среды с красителями, например генцианом фиолетовым, метаниловым желтым, ализарином, оранжевым G и др., являются селективными и их используют в качестве диагностических и дифференциальных при выделении определенных бактерий.
Ионы тяжелых металлов в невысоких концентрациях стимулируют развитие тех или иных микроорганизмов, так как являются для них необходимыми микроэлементами, входящими в состав тех или иных ферментов. Стимуляцию развития микроорганизма иногда можно наблюдать и при невысоких концентрациях солей свинца, кадмия и других металлов, очевидно, не являющихся необходимыми микроэлементами. Например, кадмий в концентрации 20 частей на миллион стимулировал рост Lactobacillus acidophilus и в концентрации 5-10 частей на миллион – рост Streptococcus faecalis, хотя при концентрации 40 частей угнетал развитие обеих этих бактерий. Стимуляция метаболизма микроорганизмов невысокими концентрациями токсических соединений может объясняться так называемым эффектом Арндт-Шульца, заключающимся в том, что аккумуляция ядра в нелетальных концентрациях на поверхности клетки изменяет проницаемость мембраны, нарушают свои барьерные функции, что определяет свободное поступление пищи в клетку и соответственно усилением метаболизма.
При увеличении концентрации солей тяжелых металлов начинает проявляться их токсический эффект. В естественных условиях в отсутствии антропогенного загрязнения содержание солей Cu, Zn, Ni и других металлов может достигать сотых и даже тысячных долей процента. Воздействие человека на окружающую среду привело к повышению концентрации тяжелых металлов в водоемах, почве и даже атмосфере. Токсическое действие могут оказывать также ионы мышьяка и сурьмы, если концентрации их солей достигает 0,001 – 1,0 г/л.
Знание о характере взаимодействия тяжелых металлов с микроорганизмами представляют большой интерес для решения вопросов общей экологии. Так, при экологическом нормировании предельно допустимых концентраций тяжелых металлов в водоемах имеет значение сведения о концентрациях тяжелых металлов, вызывающих в водоемах, почве и организме гибель отдельных микрорганизмов и разрушение их сообществ. Важна оценка вклада микроорганизмов в трансформацию соединений тяжелых металлов и детоксикацию природной среды. Такого рода данные необходимы для прогнозирования состояния окружающей среды в условиях загрязнения и разработки охранных мероприятий.
В качестве токсичных для E. coli в литературе указаны следующие концентрации солей тяжелых металлов (мг/л) : AgNO3 – 6; CdCl2 – 20; CoCl2  6H2O – 23; HgCl2 – 3; NiCl2
6H2O – 23; HgCl2 – 3; NiCl2  6H2O – 23.
6H2O – 23.
Следует иметь в виду, что вышеуказанные величины весьма условны. Действие ионов тяжелых металлов зависит от состава среды и природы соответствующих солей. Токсичность в сильной степени зависит от того, присутствует ли металл в виде свободного иона в растворе или в составе в основном недиссоциированной соли, а также входит ли данный элемент в состав органических или неорганических комплексных соединений. Недиссоциированные соли и металлы, входящие в состав комплексов, обычно менее токсичны, чем свободные ионы в тех же молярных конценрациях. В природных условиях и особенно в условиях лабораторных сред значительная часть ионов обычно входит в хелатные комплексы с органическими и неорганическими легандами. На степень токсичности соединений тяжелых металлов, мышьяка и сурьмы влияет также присутствие конкурирующих катионов или анионов независимо от того, токсичны они или нет.
Металлы влияют на многие стороны метаболизма. Они легко взаимодействуют с различными электродонорными группами в составе органических соединений, образуя комплексы с гидроксильными, карбоксильными, фосфатными и аминогруппами и ковалентные связи с сульфгидрильными группами. Поэтому эти ионы способны соединяться с белками, нуклеотидами, коферментами, фосфолипидами, порфиринами, т.е. практически со всеми классами веществ, участвующих в метаболизме клетки. Ингибирование тяжелыми металлами активности металлоферментов может быть связано с замещением специфического катиона.
Ионы тяжелых металлов часто вызывают нарушения функций цитоплазматической мембраны. Угентение функций мембраны является главным механизмом токсического действия ионов ртути и серебра, в основе таких эффектов лежит взаимодействие металлов с сульфгидрильными группами мембранных белков, хотя этот механизм не является единственным.
В присутствии ионов тяжелых металлов обычно наблюдается угнетение дыхания, механизмы этого эффекта могут быть различными, но в некоторых случаях предполагают непосредственное взаимодействие металлов с компонентами дыхательной цепи. Угнетение дыхания может определяться также нарушением транспорта его субстрата.
Бактерии способны концентрировать тяжелые металлы внутри клеток или в поверхностных структурах, извлекая их из весьма разбавленных растворов. Эта способность является характерным свойством определенных штаммов.
В клетках бактерий кишечной группы может накопиться до 90 мг. кадмия на 1 г сухой биомассы. Процесс аккумуляции элемента во времени может протекать по-разному. Иногда скорость процесса нарастает очень быстро, и максимальное накопление металла в клетках достигается через несколько секунд после начала их контакта. В других случаях для насыщения клеток требуется около часа. Иногда поглощение металла идет в две стадии: различают более быструю и более медленную стадии. Высокая скорость этого процесса характерна для тех случаев, когда он никак не связан с жизнедеятельностью клеток.
Существует большое разнообразие в распределении аккумулированных металлов. Накопление ртути, кадмия, серебра и урана происходит в основном в результате адсорбции их на поверхности клеток.
Ионы меди, цинка, никеля, кольбата, свинца, стронция, а иногда также кадмия и урана в основном транспортируется внутрь клеток, хотя часть ионов металла связывается с их поверхностью.
Активный транспорт Zn2+, Ni2+, Co2+, Sr2+, Cd2+, как правило, осуществляется системой транспорта Mg2+, а иногда системой транспорта Mn2+ и Ca2+.
Антибиотики(греч. anti – противо, bios – жизнь) – вещества, образуемые микроорганизмами и способные в малых концентрациях оказывать избирательное токсическое действие на другие микроорганизмы или клетки высших организмов. Описано более 5 тыс. различных антибиотиков. По химической природе антибиотики принадлежат к различным группам соединений. Это углеводородсодержащие аминогликозиды (группа ристомицина – ванкомицина и др.), макроциклические лактоны (макролиды, полиены и др.), хиноны и близкие к ним антибиотики (тетрациклины, антрациклины и др.), пептиды, пептолиды (пенициллины, цефалоспорины, актиномицины) и др.
Молекулярные механизмы действия антибиотиков могут быть самые разные. Ряд антибиотиков нарушает синтез клеточной стенки бактерий (пенициллины и др.), полимиксины действуют на цитоплазматическую мембрану, повышая ее проницаемость, а такде на внешнюю мембрану грамотрицательных бактерий. Известно свыше 100 антибиотиков – ингибиторов белкового синтеза, избирательно воздействующих на различные этапы этого процесса. Например, хлорамфеникол ингибирует образование пептидной связи в результате блокирования активного центра пептидилтрансферазы на 50 S-субчастицах рибосомы. Антибиотики кирромицины действуют на бактериальный фактор элонгации Tu (EF-Tu), нарушая синтез белка. Актиномицин D нарушает ДНК-зависимый синтез РНК, синтез ДНК нарушают азасерин, псикофуранин и др., блеомицины вызывают разрывы, а митомицины – сшивки комплиментарных цепей в молекуле ДНК.
Антибиотики являются вторичными метаболитами микроорганизмов, т.е. их синтез не связан с основными процессами роста, деления или энергетического метаболизма продуцента. Значение антибиотиков для продуцирующих их микроорганизмов остается неясным. Некоторые исследователи считают, что антибиотики дают преимущество продуцентам в борьбе за существование, угнетая конкурентов. Согласно другой точки зрения антибиотики представляют собой соединения с регуляторными функциями или вообще «отбросы» обмена веществ и не играют роли во взаимодействиях микроорганизмов в естественной среде. Как бы то ни было, в настоящее время в результате широкого использования в ветеринарии и медицине антибиотики стали мощным экологическим фактором, определяющим микроэволюционные процессы в популяциях бактерий. Эра антибиотиков в медицине и ветеринарии наступила в начале 40-х годов после введения в практику пенициллина. Уже вскоре были обнаружены устойчивые к пенициллину штаммы стафилококков, а затем и других видов патогенных бактерий. При изучении коллекционных штаммов Enterobacteriaceae, выделенных в годы, предшествовавшие эре антибиотиков, было обнаружено, что некоторые, хотя и очень немногочисленные штаммы обладают устойчивотью к антибиотикам ампициллину и тетрациклину. Широкое внедрение антибиотиков в практику привело к появлению и накоплению устойчивых к ним бактерий.
Механизмы устойчивости бактерий к антибиотикам различны. Иногда наблюдается изменение рецепторных молекул, с которыми связывается соответствующий антибиотик. Так, резистентность к пенициллинам, макролидам, хинолонам может быть связана с изменением соответственно пенициллинсвязывающих белков, ДНК-гиразы, РНК-полимеразы. Подобные механизмы устойчивости обнаружены у Haemophilus influenzae, представителей семейства Enterobateriaceae, стафилококков, стрептококков, псевдомонад. Резистентность, обусловленная снижением проникновения препаратов в клетку, найдена в отношении пенициллинов, цефалоспоринов, аминогликозидов и тетрациклинов у штаммов Enterobateriaceae и Pseudomonas aeruginosa. Некотрые штаммы разных видов бактерий продуцируют различные ферменты, инактивирующие или разрушающие некоторые антибиотики, в том числе хлорамфеникол, пенициллины и цефалоспорины. образование подобных ферментов детерминировано плазмидными или хромосомными генами. Детерминированные хромосомными генами индуцибельные цефалоспориназы широко распространены у штаммов видов Enterobater и Citrobacter.В некоторых случаях уровень устойчивости к антибиотику может быть увеличен путем умножения-амплификации генов, определяющих эту устойчивость. Наблюдали амплификацию как хромосомных, так и плазмидных генов. Подобный механизм обнаружен,например,у штаммов Bacillus и Staphylococcus, устойчивых к хлорамфениколу.
Особенное значение в настоящее время приобрели трансмиссивные плазмиды множественной лекарственной устойчивости – R-фактора (англ. resistance – устойчивость). R-факторы определяют устойчивость клетки одновременно к нескольким – до 9 и более – препаратам: антибиотикам, лекарственным веществам, солям тяжелых металлов. Известно много различных R-факторов, генный состав которых может легко изменяться в результате обмена генами между бактериями. Гены, определяющие устойчивость, могут быть локализованы в маленьких участках ДНК – транспозонах (Tn), которые способны перемещаться в различные участки хромосомы и на такие векторные ДНК, как плазмиды. Комбинации трансмиссивной плазмиды с транспозоном особенно благоприятна для распространения множественной лекарственной устойчивости бактерий. Идентичные гены резистентности, а иногда и идентичные плазмиды могут быть найдены в различных бактериях и в различных географических областях. Например, устойчивые к тетрациклину штаммы Haemophilus influenzae, выделенные на различных континентах, имеют одинаковую детерминанту резистентности, которая локализована на Tn 10. Сходные гены определяют устойчивость к ампициллину у штаммов Enterobateriaceae.
Воздействие на клетки бактерий токсических веществ и в не слишком высоких концентрациях, не обязательно вызывающих их гибель, можно рассматривать как один из вариантов стрессовых (англ. Stress – напряжение) воздействий. В этих условиях вступают в строй специальные системы клеточного метаболизма, способствующие выживанию организма.
| <== предыдущая страница | | | следующая страница ==> |
| Молекулярный кислород | | | Влажность. Важнейшим фактором поддержания жизни в микробной клетке является вода, в растворах которой протекают все процессы |
Дата добавления: 2014-02-26; просмотров: 1021; Нарушение авторских прав

Мы поможем в написании ваших работ!