
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Применение. Щавелевая кислота – широко распространена в природе (щавель, кислица), применяется в деревообрабатывающей промышленности для осаждения редких металлов
Щавелевая кислота – широко распространена в природе (щавель, кислица), применяется в деревообрабатывающей промышленности для осаждения редких металлов, при производстве СМС.
Малоновая кислота – содержится в свекольном соке, используется в разнообразных синтезах (витамины В1, В2).
Малеиновая кислота – применяется в пищевой промышленности для стабилизации жиров, масел, сухого молока.
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
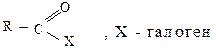 К функциональным производным карбоновых кислот относятся следующие классы органических соединений:
К функциональным производным карбоновых кислот относятся следующие классы органических соединений:
1) галогенангидриды
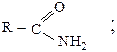
2) амиды
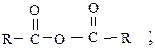
3) ангидриды
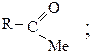
4) соли
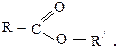
5) сложные эфиры
Все они могут быть получены при взаимодействии карбоновых кислот с различными реагентами (способы получения были рассмотрены ранее как химические свойства кислот), в результате чего гидроксил карбонильной группы замещается на галогены (F, Cl, Br) или группы OCOR1, OR1, NH2.
Остановимся подробнее на сложных эфирах – производных карбоновых кислот, в которых ацильная группа связана с алкоксильной группой:
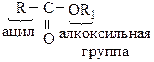
ацил – это остаток кислоты:
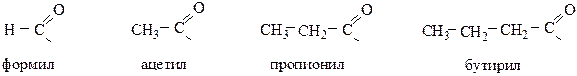
и т.д.
При названии сложных эфиров низко- и среднемолекулярных спиртов и кислот окончание в названии кислоты изменяют на “оат”:
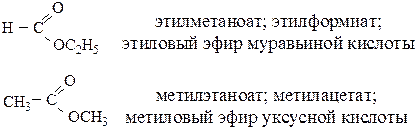
Сложные эфиры глицерина и высших карбоновых кислот являются жирами или маслами.
Основные карбоновые кислоты, входящие в состав природных липидов:
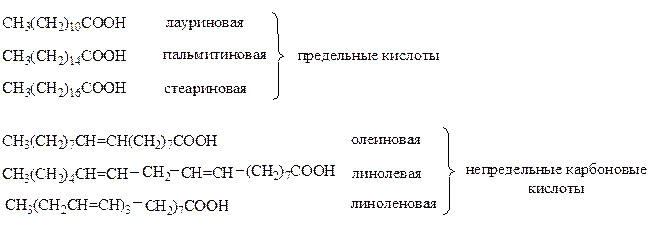
Триацилглицериды, в состав которых входят остатки одинаковых карбоновых кислот, называются простыми, разных кислот – смешанными.
Сложные эфиры высших одноосновных карбоновых кислот (с числом атомов углерода С18 – С30) и одноатомных высокомолекулярных спиртов (С18 – С30) называются восками.
ФИЗИЧЕСКИЕ СВОЙСТВА, НАХОЖДЕНИЕ В ПРИРОДЕ, ПРИМЕНЕНИЕ.
Сложные эфиры низкомолекулярных с среднемолекулярных кислот и спиртов – жидкости с приятным запахом. Сложные эфиры высокомолекулярных кислот – твердые вещества. Все практически нерастворимы в воде и хорошо растворимы в органических растворителях. Широко распространены в природе, обычно в небольших количествах.
Участвуют в разнообразных процессах, протекающих в живом организме, являются ароматобразующими компонентами ряда растений. Воски – в растениях покрывают тонким слоем листья, стебли, плоды, предохраняя их от смачивания, высыхания, действия микроорганизмов. Некоторые используются в пищевой промышленности в качестве глазирующих агентов.
Низко- и среднемолекулярные сложные эфиры применяются в пищевой промышленности как ароматизаторы (этилформиат – в качестве ромовой эссенции, т. к. обладает запахом рома; изоамилацетат – в качестве грушевой эссенции; этилбутират – ананасовой эссенции).
Особый интерес представляют сложные эфиры высших карбоновых кислот с глицерином – ацилглицерины, являющиеся липидами (жирами или маслами). Они широко используются при получении многих продуктов питания, являются важными компонентами пищевого сырья, полупродуктов или готовых пищевых продуктов, во многом определяя их пищевую и биологическую полноценность и вкусовые качества.
ХИМИЧЕСКИЕ СВОЙСТВА СЛОЖНЫХ ЭФИРОВ
1) Гидролиз протекает под влиянием щелочей, кислот либо ферментов. Получается смесь исходной кислоты и спирта.
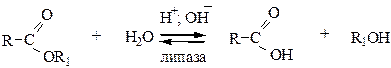
1.1 Омыление. Гидролиз концентрированными водными растворами NaOH называется омылением и является основой процесса получения (варки) мыла:
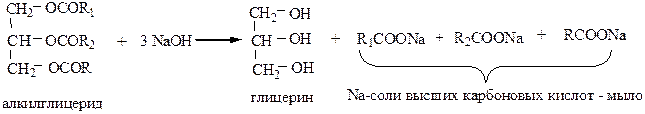
2) Переэтерификация. В присутствии оснований глицериды способны обмениваться ацилами:
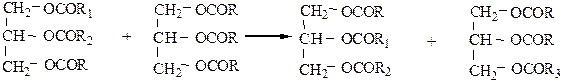
В результате образуется жир, отличающийся по своим свойствам от исходного, т.е. можно, например из смеси твердого и жидкого жира, получить жир промежуточной консистенции (повышенной пластичности). Реакция проводится при t=50-90 oC в присутствии катализатора (этилата Na, метилата Na, сплава Na и К).
3) Гидрогенизация используется для получения твердых или полутвердых жиров из жидких (масел). Процесс насыщения двойных связей, содержащихся в кислотных остатках водородом:
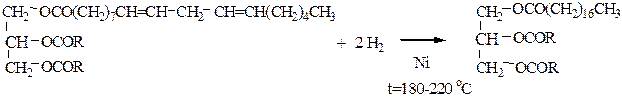
Меняя условия гидрогенизации, можно получить продукты разной степени насыщенности.
4) Окисление. Если в состав жира или масла входят остатки ненасыщенных карбоновых кислот, то жиры могут окисляться кислородом воздуха:
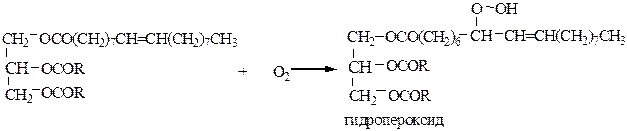
В результате реакции образуется первичный продукт окисления – гидропероксид, который при стоянии подвергается дальнейшим превращениям, образуя спирты, альдегиды, кетоны, карбоновые кислоты. Накопление этих продуктов приводит к изменению вкусовых качеств жира и называется прогорканием.
На практике в пищевой промышленности состав и качество жиров и масел характеризуется с помощью разнообразных “чисел”, подразумевая под ними расход определенных реагентов на реакции с жиром.
Йодное число – это количество (г) I2, которое может быть присоединено к 100 г данного жира. Данный показатель характеризует вид жира (ненасыщенность), способность его к “высыханию”. Используется для расчета потребного количества водорода на его гидрогенизацию, т.е. чем больше йодное число, тем жир более жидкий.
Кислотное число – показатель, характеризующий количество свободных жирных кислот, содержащихся в жире. Выражается в мг КОН, затраченного на нейтрализацию кислот, содержащихся в 1 г жира. По величине кислотного числа можно судить о качестве жира.
Число омыления – количество (мг) КОН, необходимое для омыления карбоновых кислот в 1 г жира. По числу омыления можно судить о средней молекулярной массе входящих в состав жира кислот.
ГИДРОКСИКИСЛОТЫ
Гидроксикислоты – органические соединения, содержащие в молекуле 2 функциональные группы: –ОН (гидроксильную) и –СООН (карбоксильную).
В зависимости от количества карбоксильных групп различают одно-, двух-, трех- и многоосновные кислоты; по количеству гидроксильных групп (включая гидроксильную группу, входящую в карбоксил) – двух, трех- и многоатомные гидроксикислоты.
По строению углеводородного радикала гидроксикислоты делятся на алифатические (насыщенные и ненасыщенные), ароматические, гетероциклические.
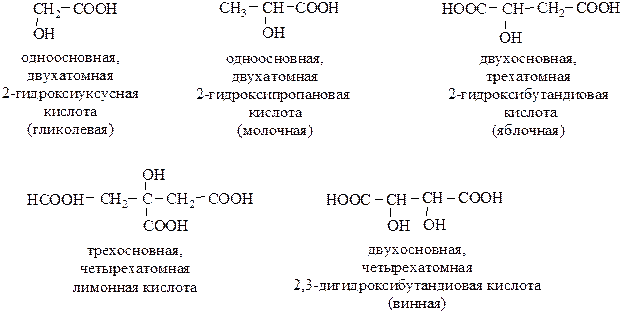
Структурная изомерия определяется строением углеводородного радикала, положением функциональных групп и их взаимным расположением. Различают α-, β–, γ– и т.д. гидроксикислоты:

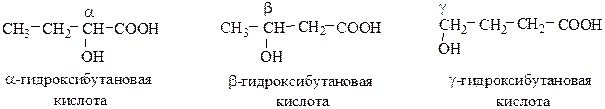
Для гидроксикислот, содержащих хотя бы один асимметрический атом углерода (С*), характерна оптическая изомерия.
Атом углерода является асимметрическим, если он связан с четырьмя различными заместителями:
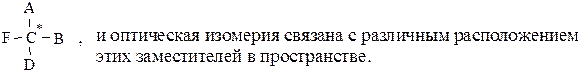
Большинство веществ, имеющих асимметрический атом углерода, способны поворачивать плоскость плоскополяризованного света при прохождении его через свежеприготовленные растворы этих веществ вправо или влево. Эта способность называется оптической активностью и характеризуется удельным вращением:

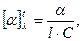
где 

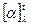 – угол удельного вращения при длине волны
– угол удельного вращения при длине волны 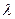 и температуре
и температуре 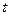 ;
;
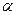 – угол вращения раствора вещества;
– угол вращения раствора вещества;
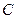 – концентрация вещества;
– концентрация вещества;
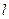 – длина кюветы.
– длина кюветы.
Перестановкой любых двух заместителей в пространстве можно получить оптические изомеры данного вещества. При наличии в молекуле одного асимметрического (хирального, от греческого “хирос” – рука) атома углерода существуют 2 стереоизомера, являющихся как бы зеркальным изображением друг друга. Такие изомеры называются энантиомерами или оптическими антиподами:
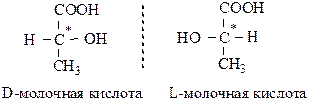
С* – асимметрический атом. Один из них вращает плоскополяризованный свет вправо: (+)-форма; другой – влево на точно такой же угол: (–)-форма. Большинство других физических и химических свойств у антиподов одинаковы.
Эквимолярная смесь оптических антиподов не обладает оптической активностью (правовращающие антиподы полностью компенсируются левовращающими), и называется рацематом (например, виноградная кислота с (+) и (–)-винными кислотами).
Если в молекуле несколько асимметрических атомов углерода, то количество стереоизомеров определяется по формуле:
N=2n, где N – количество стереоизомеров; n – число асимметрических атомов углерода.
Так, для 2,3-дигидроксибутановой кислоты существует 4 стереоизомера (n=2, N=22=4):
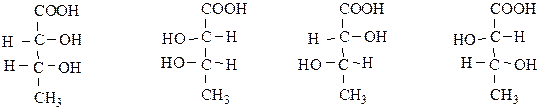
Для каждого изомера существует только 1 антипод (зеркальное отображение), все остальные называются диастереомерами.
При наличии в молекуле плоскости симметрии:
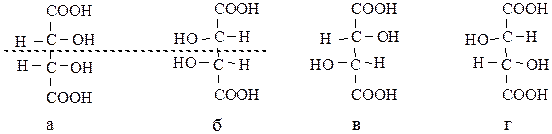
количество стереоизомеров оказывается меньше, чем это определяется по вышеприведенной формуле. Такая молекула является внутримолекулярным рацематом и не обладает оптической активностью (вещества а, б). Этот стереоизомер не имеет антипода и называется мезо-формой.
Оптические изомеры, у которых предпоследний гидроксил расположен справа, называют D-конфигурацией, слева – L-конфигурацией:
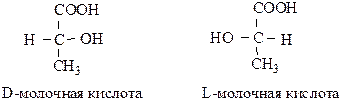
СПОСОБЫ ПОЛУЧЕНИЯ
Гидроксикислоты могут быть получены из спиртов введением карбоксильной группы, либо из карбоновых кислот введением гидроксильной группировки.
1) Гидролиз галогенозамещенных кислот проводится водным раствором щелочи.
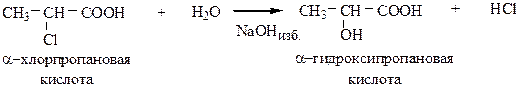
Необходимо брать избыток щелочи, чтобы нейтрализовать карбоксильную группу.
2) Гидратация непредельных кислот (присоединение Н2О по двойной связи) протекает против правила Марковникова.
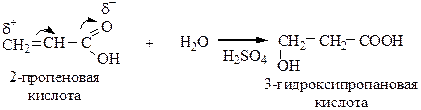
3) Оксинитрильный синтез позволяет получать гидроксикислоты из альдегидов и кетонов.

4) Окисление двух и многоатомных спиртов. При использовании строго рассчитанного количества окислителя можно получить соответствующую спиртокислоту.
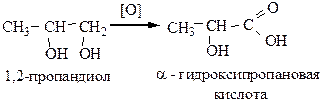
ФИЗИЧЕСКИЕ СВОЙСТВА.
Гидроксикислоты – бесцветные, вязкие жидкости или кристаллические вещества. Низшие – хорошо растворимы в воде, с увеличением молекулярной массы растворимость уменьшается.
ХИМИЧЕСКИЕ СВОЙСТВА
Химическое поведение гидроксикислот определяется их бифункциональностью (т.е. наличием двух функциональных группировок), они могут проявлять практически все химические свойства, характерные для карбоновых кислот по карбоксильной группе, и свойства, характерные для спиртов, по гидроксильной. Гидроксикислоты являются более сильными кислотами, чем обычные карбоновые.
Отличие в поведении α-, β- и γ-гидроксикислот.
При нагревании гидроксикислоты ведут себя по-разному.
1) α-гидроксикислоты образуют циклический сложный эфир-лактид:
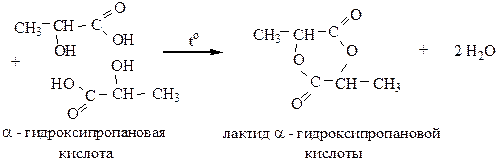
2) β-гидроксикислоты при нагревании отщепляют воду внутримолекулярно с образованием непредельных карбоновых кислот:
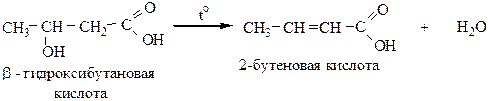
3) γ- и δ-гидроксикислоты при нагревании образуют внутренние сложные эфиры-лактоны:
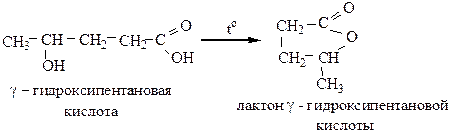
Углеводы. Определение, строение,
нахождение в природе.
Углеводы – биоорганические соединения, имеющие в своем составе 2 функциональные группировки: гидроксильную и карбонильную. Количество гидроксильных групп в моносахаридах – от 3-х до 5-ти, поэтому углеводы могут быть рассмотрены как многоатомные альдегидо- или кетоспирты. Большинство этих веществ имеет состав CnH2nOn, т.е. количество атомов углерода равно количеству атомов кислорода.
Название «углеводы» возникло при анализе первых известных представителей этого класса. Было установлено, что они состоят из С, Н, О, причем соотношение водород:кислород такое же, как в воде – 2:1. Поэтому такие соединения рассматривали как соединения углерода с водой. Углеводы широко распространены в природе, являются первичными продуктами фотосинтеза, в растениях до 80 % сухого вещества приходится на углеводы, содержание в живых организмах составляет ≈ 20 % сухого вещества. Различные производные углеводов, входящие в состав клеток живого организма, являются конструкционным материалом, регуляторами биохимических реакций, поставщиками энергии. В соединении с белками, липидами, в составе нуклеиновых кислот углеводы образуют сложные высокомолекулярные кетоспирты, представляющие собой основу живой материи.
Классификацию углеводов можно представить следующим образом:
Углеводы
 |  |
простые сложные

 (моносахариды, монозы) (полисахариды, полиозы)
(моносахариды, монозы) (полисахариды, полиозы)
 | |||
 | |||
альдозы кетозы низкомолекулярные, высокомолекулярные,
 сахароподобные несахароподобные
сахароподобные несахароподобные



 (олигосахариды)
(олигосахариды)


 гомополи- гетерополи-
гомополи- гетерополи-
сахариды сахариды
триозы (С3) восстанав- невосстанав-
тетрозы (С4) ливающие ливающие
пентозы (С5)
гексозы (С6)
Простые углеводы не способны гидролизоваться с образованием более простых улеводов; сложные углеводы – гидролизуются с образованием более простых углеводов. Формула сложных углеводов CmH2nOn, т.е количество атомов углерода не равно количеству атомов кислорода.
В природе наиболее распространены углеводы, содержащие в своем составе альдегидную группу – альдозы.
D-ряд альдоз
(формулы Фишера, гидроксикарбонильные формы)

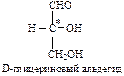
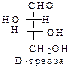
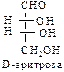
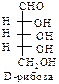
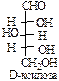
 |
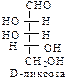
 |

 |  |
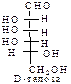
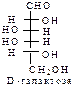
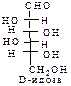
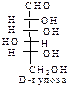
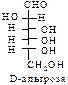
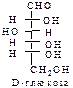

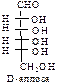
 |  |  |  |  | |||||||||||
 | |||||||||||||||
 |  | ||||||||||||||
Важнейшие представители моносахаридов – глюкоза (виноградный сахар) и фруктоза (фруктовый сахар). Они изомерны друг другу и имеют формулу С6Н12О6. Глюкоза – пятиатомный альдегидоспирт, фруктоза – пятиатомный кетоспирт:
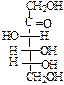
Все моносахара содержат в своем составе асимметрический атом углерода С* (в глюкозе их 4), поэтому для них существуют стереоизомеры, количество которых определяется по формуле N=2n. Для глюкозы N=24=16, причем половина оптически деятельных стереоизомеров является антиподами (зеркальными изображениями) другой половины, т.е. 16 стереоизомеров образуют 8 пар антиподов.
Нумерацию цепи в углеводах ведут, начиная с альдегидной группы у альдоз, у кетоз – с того конца цепи, к которому ближе кетогруппа. Розанов предложил судить о принадлежности углеводов к D- или L-ряду по расположению в пространстве атомных групп у предпоследнего атома углерода: если конфигурация у него совпадает с конфигурацией D-глицеринового альдегида, то такие углеводы относятся к D-ряду (предпоследний гадроксил справа), если нет – то к L-ряду (предпоследний гидроксил слева). Не путать с направлением вращения, которое обозначается “+” – вправо, “–” – влево.
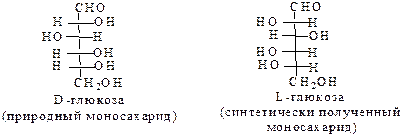
Гидроксикарбонильные формулы углеводов не могли объяснить некоторые факты:
1. отсутствие некоторых реакций на альдегидные группы (не дают окрашивание с фуксинсернистой кислотой, не реагируют с NaHSO3);
2. все моносахара обладают оптической активностью, однако угол вращения плоскости плоскополяризованного света при стоянии свежеприготовленных растворов сахаров изменяется – явление мутаротации (для D-глюкозы от +106о до 52,5о);
3. если исходить из формул Фишера, то количество стереоизомеров для гексоз – 16. Однако, оказалось, что каждый моносахарид может существовать в двух индивидуальных кристаллических формах с различными физическими константами (для глюкозы – 2 формы с углами вращения +106о и +22,5о, которые при стоянии в растворах меняют угол до +52,5о). Таким образом, реально существуют 32 стереоизомера, т.е. их количество удваивается;
4. одна из гидроксильных групп в углеводах обладает особыми химическими свойствами (при нагревании со спиртами в присутствии сухого HCl образуются гликозиды, которые в присутствии разбавленных минеральных кислот легко гидролизуются с образованием 1 молекулы спирта и 1 молекулы углевода, а не пяти молекул, хотя гидроксилов в гексозах пять);
Все эти факты были объяснены, когда было доказано, что углеводы могут существовать как в виде гидроксикарбонильных, так и в виде циклических форм. Переход из циклических форм при растворении углеводов в воде называется таутомерным переходом:
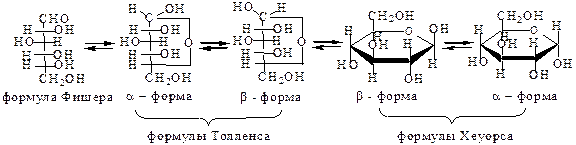
Вновь образовавшийся гидроксил у нового асимметрического атома углерода С* (поэтому N=25=32), называется полуацетальным или гликозидным. Он отличается от всех остальных спиртовых гидроксилов тем, что он более реакционноспособен. Если полуацетальный гидроксил расположен по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду (окисным кольцом), то такая форма называется α-формой; если по разные – β-форма.
Кольцо циклической формы может быть шестичленным (пиранозная форма – от пирана) и пятичленным (фуранозная форма – от фурана):
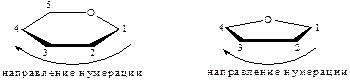
Заместители, располагающиеся в формулах Толленса справа от цепи, помещаются внизу (под кольцом) в формулах Хеуорса, те, которые слева – наверху (над кольцом). Концевую (CH2OH) группу – последнюю помещают наверху, если углеводы принадлежат к D-ряду, и внизу, если – к L-ряду.
СПОСОБЫ ПОЛУЧЕНИЯ
1. Гидролиз ди- и полисахаридов. Происходит под действием разбавленных минеральных кислот или ферментов
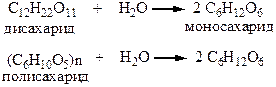
2. Оксинитрильный синтез. Метод удлинения углеводородной цепи углеводов.
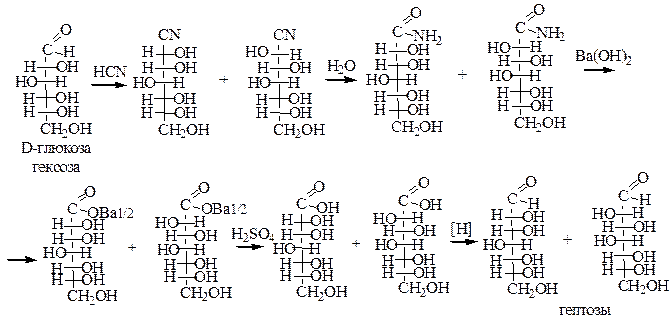
3. Альдольная конденсация формальдегида в присутствии Ca(OH)2
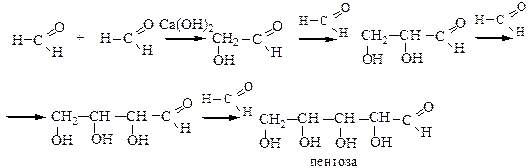
4. Метод укорачивания углеродной цепи углеводов (распад по Руффу). Используется для получения малодоступных сахаридов. При действии Н2О2 в присутствии ацетата трехвалентного железа, карбонильный углерод отщепляется в виде Н2СО3, а атом, стоящий рядом с ним – окисляется до альдегидной группы:
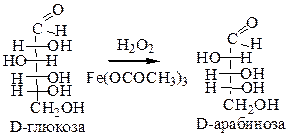
| <== предыдущая страница | | | следующая страница ==> |
| Применение. Акриловая кислота – ее эфиры применяют для получения ценных полимерных материалов (органического стекла) | | | Физические свойства |
Дата добавления: 2014-04-15; просмотров: 1234; Нарушение авторских прав

Мы поможем в написании ваших работ!