
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Применение
Азокрасители используются в различных видах промышленности (пищевой, текстильной, бумажной и др.) для придания товару определенного цвета, либо в аналитической химии как индикаторы (так как меняют цвет в зависимости от значения рН).
Паракрасный краситель используется для окраски хлопчатобумажных тканей:
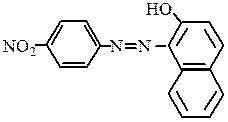
Метиловый оранжевый – используется как индикатор, в щелочной среде имеет желтый цвет, в кислой – розово-красный:

Тартразин – используется в пищевой промышленности для окрашивания продуктов в желтый цвет
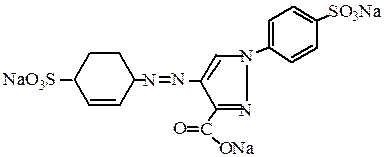
так же, как и солнечный желтый
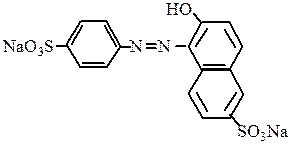
Синтетические красители устойчивы, дешевы, обладают большой окрашивающей способностью, но не приносят пользы для здоровья человека. Некоторые из них запрещены к применению (Е 127 – эритрозин, Е 123 – амарант, Е 121 – «цитрусовый красный 2»).
АМИНЫ
Амины рассматриваются как производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы. Различают:
первичные амины – R−NH2
вторичные амины – R−NH−R1
 третичные амины –
третичные амины –
Известны соединения, содержащие четвертичный атом азота:
 а) четвертичный гидроксид аммония
а) четвертичный гидроксид аммония
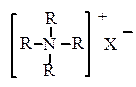 б) четвертичные аммонийные соли
б) четвертичные аммонийные соли
В зависимости от строения радикала различают алифатические (насыщенные, ненасыщенные), алициклические, ароматические (с аминогруппой в ядре или боковой цепи) и гетероциклические амины. Изомерия аминов зависит от строения радикала.
При составлении названия аминов используют радикально-функциональную номенклатуру (функциональная аминогруппа имеет суффикс “амин”):
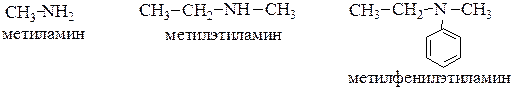
Ароматические амины рассматриваются как производные углеводородов:

СПОСОБЫ ПОЛУЧЕНИЯ
1. Восстановление нитросоединений (реакция Зинина). Проводится двумя методами:
а) восстановлением железными стружками в присутствии раствора хлорида железа (III)
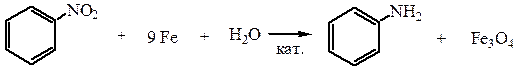
б) каталитическим гидрированием молекулярным водородом в присутствии меди, нанесенной на диоксид кремния при t=270-300 оС и р=15,2·104 Па
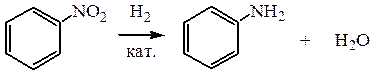
2. Алкилирование аммиака. Проводится:
а) галогеналкилами (реакция Гофмана), при этом атомы водорода в аммиаке постепенно замещаются на углеводородные радикалы

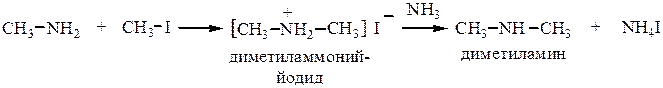
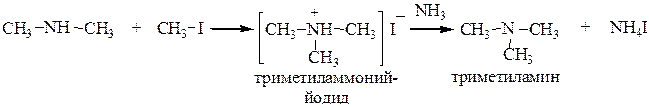
б) спиртами (широко используется в промышленности для получения алифатических аминов). Смесь спирта с аммиаком или амином или амином пропускают над катализатором (Al2O3) при t=300 оС
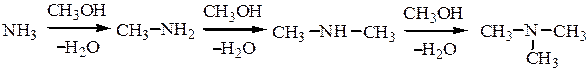
3. Получение первичных аминов из амидов карбоновх кислот (перегруппировка Гофмана). Происходит при действии гипохлоридов или гипобромидов
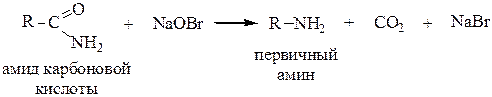
4. Восстановление нитрилов и изонитрилов. Проводится металлическим Na в спирте или водородом в присутствии катализатора (Pd). Нитрилы при восстановлении дают первичные амины
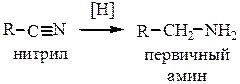
Изонитрилы – вторичные амины
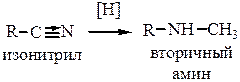
5. Восстановительное алкилирование аммиака и аминов карбонильными соединениями. Проводится смесью карбонильных веществ и водорода в присутствии катализаторов (Ni, Pt, Pd)
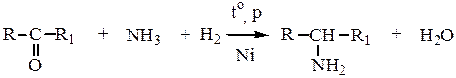
Физические свойства
Низшие алифатические амины – бесцветные, газообразные, горючие вещества, растворимы в воде. Обладают характерным запахом испорченной рыбы. С увеличением молекулярной массы растворимость уменьшается. Ароматические амины – бесцветные жидкости или твердые вещества с неприятным запахом, ядовиты.
ХИМИЧЕСКИЕ СВОЙСТВА
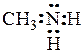 Химические свойства аминов определяются наличием аминогруппы, которая имеет следующее строение: на внешней электронной оболочке атома азота имеется 5 свободных электронов. На связи с атомами углерода и водорода азот затрачивает всего 3 электрона, т.е. 2 электрона остаются свободными:
Химические свойства аминов определяются наличием аминогруппы, которая имеет следующее строение: на внешней электронной оболочке атома азота имеется 5 свободных электронов. На связи с атомами углерода и водорода азот затрачивает всего 3 электрона, т.е. 2 электрона остаются свободными:
Таким образом, азот в аминах имеет неподеленную пару электронов, к которой может присоединиться протон, поэтому амины, как и аммиак, проявляют основные свойства (образуют гидроксиды, соли). В этих реакциях амины, отдавая свои электроны на образование связи ведут себя как нуклеофильные агенты. Амины являются более сильными основаниями, чем гидроксильные производные, так как атом азота отдает электроны легче, чем атом кислорода.
Основность характеризуется константой равновесия реакции:
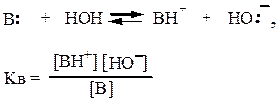
Обычно используют величину рКв = −lg Кв. Чем меньше рКв, тем сильнее основание:
рКв
аммиак 4,76
метиламин 3,35
триметиламин 4,26
анилин 9,42
Таким образом, основность аминов сильно зависит от природы радикалов. Алифатические амины более сильные основания, чем ароматические, т.к. в последних – пара электронов на атоме азота вступает в сопряжение с π-комплексом ядра:
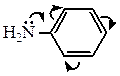
В водных растворах низшие амины имеют щелочную реакцию.
1. Образование гидроксидов. В водных растворах образуются алкилзамещенные гидроксиды аммония
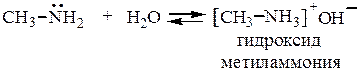
2. Образование солей. Под действием минеральных кислот амины дают четвертичные аммонийные соли
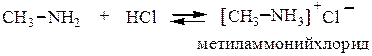
3. Реакция алкилирования. Проводится галогенопроизводными или спиртами. Рассмотрена ранее как способ получения аминов.
4. Реакция ацилирования. Проводится ангидридами, хлорангидридами или сложными эфирами карбоновых кислот с образованием алкиламидов кислот. Третичные амины не вступают в эту реакцию.
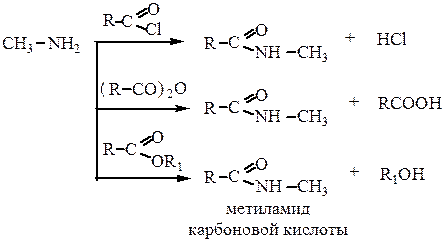
5. Взаимодействие с азотистой кислотой. Позволяет различить первичные и вторичные амины. Третичные алифатические амины в реакцию не вступают.
а) Первичные ароматические амины дают соли диазония (реакция диазотирования):
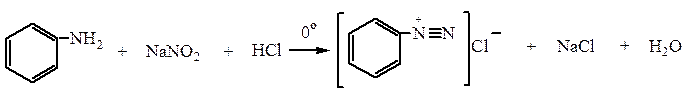
Образующаяся HNO2 из NaNO2 + HCl действует в момент выделения на ароматический амин.
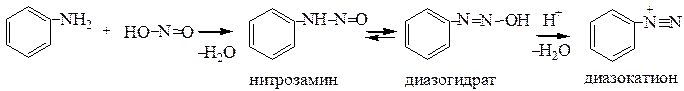
б) Первичные алифатические амины реагируют по той же схеме, но образующаяся соль, в отличие от ароматических аминов, нестабильна и разлагается с выделением N2 (по объему N2 определяют количество амина).
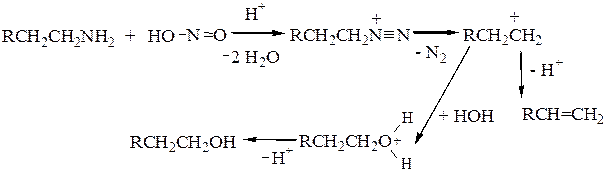
в) Вторичные алифатические амины образуют устойчивые нитрозамины, обладающие канцерогенными свойствами (поэтому в пищевых продуктах опасно присутствие нитритов и нитратов).
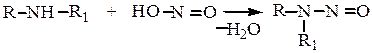
г) Третичные ароматические амины вступают в реакцию электрофильного замещения в п-положение с образованием п-нитрозосоединений.
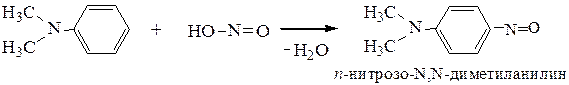
6. Изонитрильная реакция. Качественная на первичные амины, т.к. образуются очень ядовитые изонитрилы, имеющие очень неприятный запах. Вторичные и третичные амины не дают этой реакции. Реакция идет при нагревании аминов с хлороформом в присутствии КОН.
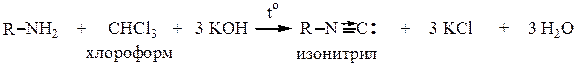
7. Окисление аминов. Происходит очень легко, даже кислородом воздуха, особенно ароматических аминов, которые при стоянии на воздухе быстро темнеют, поэтому они могут быть использованы в качестве антиоксидантов. При окислении обычными окислителями образуется трудноразделимая смесь веществ.
Если окисление ведется хромовой смесью, то можно выделить хиноны:
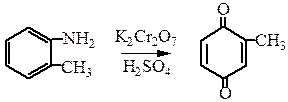
При действии перкислот образуются нитросоединения:

8. Реакции бензольного ядра ароматических аминов. Так как группа NH2 является заместителем 1-го рода, электронодонорным, то она облегчает реакции электрофильного замещения в ядре и направляет их в орто- и пара-положения.
Применение.
Амины применяются в качестве растворителей, в производстве красителей, ПАВ, фармацевтических препаратов, полимерных материалов. Алкиламины – при производстве инсектицидов и в процессе вулканизации каучука.
| <== предыдущая страница | | | следующая страница ==> |
| Физические свойства. Соли диазония – бесцветные кристаллические вещества | | | АМИНОКИСЛОТЫ |
Дата добавления: 2014-04-15; просмотров: 1229; Нарушение авторских прав

Мы поможем в написании ваших работ!