
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 3. ФЕРМЕНТЫ (F)
Понятие и коммуникативные характеристики спонсорства
Спонсорство - это система взаимовыгодных договорных отношений между спонсором и субсидируемой стороной (реципиентом), общей целью которой является достижение коммуникативно-маркетинговых целей спонсора.
Спонсор – организация или частное лицо, финансирующие какое-либо мероприятие, деятельность коллективов или отдельных лиц.
Меценат в целом занимается тем же самым. Древнеримский вельможа Меценат в свое время покровительствовал и оказывал финансовую поддержку развитию искусства и науки. Впоследствии его имя стало нарицательным для всех, кто пошел по его стопам.
Спонсора и мецената различает только одно. Меценат финансирует из любви к искусству. Спонсор стремится получить определенный рекламный эффект от своей деятельности.
Типы спонсорских пакетов:
- титульный спонсор (100% стоимости проекта)
- генеральный спонсор (50%)
- официальный спонсор (до 25%)
- спонсор – участник (до 10%)
- информационные спонсоры (СМИ, широко освещающие проект)
- технические спонсоры (компании, предоставляющие продукцию или услуги)
В большинстве случаев эти обязательства закрепляются в заключаемых договорах. Так, например, спонсор берет обязательства предоставить в распоряжение субсидируемой стороны деньги и/или другие предпринимательские ресурсы (например, свои товары, услуги, сырье и т.п.). Спонсироваться могут конкретные лица, группы лиц, организации или мероприятия, различные кампании в разнообразных областях человеческой деятельности. С другой стороны, реципиент обязуется предпринимать действия, которые непосредственно или косвенно должны способствовать достижению маркетинговых целей спонсора. Совокупность привилегий, получаемых спонсором, обычно называется спонсорским пакетом.
Например, спонсируемый может взять на себя обязательства упоминать спонсора во всех своих публичных выступлениях и публикациях в средствах массовой информации. Кроме того, субсидируемая сторона (например, спортивная команда) может пропагандировать фирменное наименование, символику, другие элементы фирменного стиля спонсора.
В зависимости от типа основной целевой аудитории вся коммуникативная деятельность фирмы по спонсорингу может иметь три основных направления:
1. Спонсоринг, ориентированный непосредственно на потребителей, нацелен, в первую очередь, на решение следующих коммуникативных задач:
1.1. Формирование осведомленности о фирме-спонсоре;
1.2. Напоминание об уже широко известной фирме;
1.3. Создание или укрепление благоприятного имиджа спонсора посредством передачи ему основных характерных черт образа субсидируемой стороны. Например, большинство известных зарубежных производителей сигарет выступают спонсорами спортсменов и спортивных мероприятий таких "мужественных" видов спорта, как соревнования гоночных автомобилей класса "Формула-1".
2.Основными коммуникационными задачами спонсоринга, направленного на формирование широкого общественного мнения, являются следующие:
2.1. Создание положительного имиджа у "широкой публики".
Для этого фирма-спонсор может продемонстрировать общественности социальные аспекты своей деятельности, например помощь медицинским учреждениям, безвозмездную передачу каких-либо средств остро нуждающимся в них (детям-сиротам, инвалидам, престарелым и т.д.);
2.2. Демонстрация финансовой мощи, которая преследует цель формирования образа надежного, устойчивого, с точки зрения имеющихся средств, партнера. При этом объектом спонсирования может быть крупномасштабная акция, например международные соревнования, День города и т.п.
3. Спонсорство, направленное наформирование коммуникаций с сотрудниками самой фирмы-спонсора, решает следующие задачи:
3.1. Мотивация труда сотрудников.
Например, лучшие сотрудники могут быть приглашены на мероприятия, проводимые за счет фирмы (концерты, соревнования, встречи с популярными актерами и т.п.);
3.2. Создание у сотрудников и тех, кто придет работать на фирму завтра, положительного образа фирмы;
3.3. Привлечение наиболее способных, талантливых людей к сотрудничеству с фирмой-спонсором. Например, фирмы IBM и "Hitachi", деятельность которых связана с наукоемкими технологиями, практикуют выплату фирменных стипендий наиболее одаренным студентам. Студенты-стипендиаты, как правило, становятся впоследствии сотрудниками этих фирм. Спонсоры же в данном случае вкладывают деньги в подготовку своих будущих компетентных специалистов.
Среди наиболее перспективных и часто субсидируемых областей человеческой деятельности, в которые вкладывают средства спонсоры, такие:
• спорт;
• сфера культуры и искусства;
• социальная сфера.
ЛЕКЦИЯ № 2. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
1.Физико-химические свойства белков. Их использование для разделения белков.
2.Принципы классификации белков.
3.Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S ( в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
2.Способность белков связываться с ЛИГАНДАМИ,
Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ.
Fe2+ ¬O2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков - АФФИНАЯ ХРОМОТОГРАФИЯ (разделение по сродству).
3.Электрохимические свойства белков.
А. АМФОТЕРНОСТЬ.
Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ.

АМФОТЕРНОСТЬ обусловлена:
1. Концевыми СООН и NH2 группами.
2.Боковыми группами:
ГЛУ, АСП -дополнительные кислотные СВОЙВТВА. АРГ, ЛИЗ, ГИС - основные свойства.
Т.к. белковые молекулы имеют много ИОНОГЕННЫХ групп, следовательно, они ПОЛИЭЛЕКТРОЛИТЫ. БЕЛКИ являются АМФОЛИТАМИ.
Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН.
B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды.
Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. Значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой.
PI кислые белки<7 (белки протоплазмы)
РI основные белки >7 (ядерные белки).
В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ:
1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ.
Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой.
2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины.
4.Коллоидные свойства белков.
Белковые растворы весьма устойчивы ,их иногда относят к истинным растворам , высокая молекулярная масса придаёт белковым растворам коллоидные свойства.
A. Оптические свойства:
- ОПАЛЕСЦЕНЦИЯ - дифракция световых лучей при прохождении через раствор и, следовательно, наблюдение его некоторого потемнения при взгляде под прямым углом к источнику света.
- Рассеивание света ( конус ТИНДАЛЯ).
Оптические свойства используются в световой микроскопии, нефелометрии, ТУРБОДИМЕТРИИ.
При нефелометрии измеряется интенсивность отраженного света. При ТУРБОДИМЕТРИИ измеряется интенсивность проходящего света.
Б. Высокая вязкость растворов белка.
B. Малая скорость диффузии.
Г. Неспособность белков проникать через полупроницаемые мембраны. Давление, обусловленное белками, называется ОНКОТИЧЕСКИМ. Диализ - очистка белковых растворов
от низкомолекулярных веществ. В клинике используется ГЕМОДИАЛИЗ - очистка крови от азотистых компонентов.
Д. Способность белковых растворов переходить из состояния золя в гель. Гель хорошо образует миозин и др. фибриллярные белки.
5. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
-полярных групп;
-ПЕПТИДНЫХ связей.
100 г. белка связывает 30-35 г. воды. Способность связывать воду изменяется с возрастом. Вода может проникать в молекулы и связываться с внутренними структурами белка, и образованием раствора воды в белке. Вода может связываться и с наружными структурами белка с образованием ГИДРАТНОЙ оболочки.
6. Растворимость белков в воде (устойчивость белков в водном растворе). Многие белки хорошо растворимы в воде, что определяется количеством полярных групп. Растворимость глобулярных молекул лучше, чем фибриллярных белков. Факторы, определяющие стабильность белковых растворов:
- наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
- Наличие ГИДРАТНОЙ оболочки, препятствующей объединению белковых молекул. Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является вливание - осаждение белка с помощью нейтральных солей - (NH4)2-S04.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
7.ЛАБИЛЬНОСТЬ пространственной структуры белка. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои НАТИВНЫЕ, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы ( повышение температуры, давления, механическое воздействие, УЗ, ионизирующее излучение), химические факторы ( кислоты, щелочи, органические растворители -спирт, фенол; соли тяжёлых металлов).n В некоторых случаях возможна РЕНАТУРАЦИЯ, когда денатурирующий фактор действовал кратковременно и нанёс лёгкое разрушение молекуле. В последние годы установлено, что в организме есть белковые системы предупреждающие денатурацию. Они тоже белковой природы - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки др. белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса.
КЛАССИФИКАЦИЯ БЕЛКОВ.
1 .По функции выделяют:
1. Транспортные белки (гемоглобин ® О2, альбумин жирные кислоты).
2. Каталитические (ферменты),
3. Регуляторные (гормоны).
4. Структурные (белки соединительной ткани, мембранные белки).
5. Защитные (антитела).
6. Сократительные (актин, миозин).
7. Рецепторные участвуют в образовании рецепторов.
2. По форме выделяют:
1. Глобулярные.
2. Фибриллярные белки.
3. По структуре белки делятся:
1.Простые (ПРОТЕИНЫ) состоят только из АК (ГИСТОНЫ, ПРОТАМИНЫ, АЛЬБУМИНЫ, ГЛОБУЛИНЫ, ГЛЮТЕМИНЫ, ПРОЛОНГИНЫ, ПРОТЕИНОИДЫ).
2.Сложные (ПРОТЕИДЫ) состоят из белков и небелковой части. Белковая часть -АПОПРОТЕИНЫ+ ПРОСТЕТИЧЕСКАЯ группа = ХОЛОПРОТЕИНЫ. Это НУКЛЕОПРОТЕИНЫ, ЛИПОПРОТЕИНЫ, ГЛИКОПРОТЕИНЫ, ХРОМОПРОТЕИНЫ, ФОСФОПРОТЕИНЫ, МЕТАЛЛОПРОТЕИНЫ.
Лекция № 3. ФЕРМЕНТЫ (F).
1. Понятие о F.
2.Строение F.
3.Коферменты (KO-F).
ПОНЯТИЕ О ФЕРМЕНТАХ.
Ферменты - это биологические катализаторы (КАТ) белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молекул ферментов, которые катализируют более 2000 различных химических реакций. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные. Энзимология (ферменты - энзимы) - раздел науки, изучающий ферменты.
ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ.
1 .Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические КАТ).
УРЕАЗА (гидролиз мочевины) повышает скорость реакции в 10 раз.

2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты, в отличие от неорганических КАТ, обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из АК, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными.
Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации (ГЛОБУЛА).
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы.
Для многих ферментов его АПОФЕРМЕНТ вместе с КОФАКТОРОМ образуют каталитически активную молекулу, которая называется ХОЛОФЕРМЕНТОМ.
АПОФЕРМЕНТ+КОФАКТОР=ХОЛОФЕРМЕНТ.
СТРОЕНИЕ ФЕРМЕНТОВ.
В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, АЛЛОСТЕРИЧЕСКИЙ центр).
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении ( недоступном для молекул воды), изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК:
- NH2 (АРГ,ЛИЗ)
- СООН (АСП, ГЛУ)
- SH (ЦИС)
- ОН (СЕР,ТРЕ)
- ИМИДАЗОЛ (ГИС)
- ГУАНИДИНО группа Фенольное кольцо (ТИР)
Остальные АК поддерживают пространственную конфигурацию активного центра фермента
и обеспечивают его реакционную способность.
Контактный ( субстрат связывающий ) участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
АЛЛОСТЕРИЧЕСКИЙ (регуляторный) центр - участок в молекуле фермента, расположенный в др. месте, в отличие от активного центра. К АЛЛОСТЕРИЧЕСКОМУ центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата. Эти вещества называются АЛЛОСТЕРИЧЕСКИЕ ЭФФЕКТОРЫ. Они могут влиять на КОНФОРМАЦИЮ активного центра фермента, изменяя её, т.е. могут или повышать скорость реакции, или тормозить её. В роли АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ чаще всего выступают гормоны, лекарственные вещества и др. химические соединения.
КОФЕРМЕНТЫ (Ko-F).
КОФЕРМЕНТЫ являются или акцепторами, или донорами различных атомов, или даже атомных групп. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы:
1.Витаминные.
2.Невитаминные.
Витаминные КОФЕРМЕНТЫ:
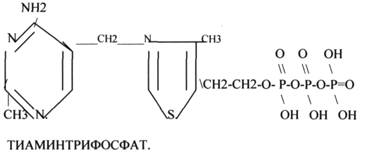
1.ТИАМИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В1 (ТИАМИН).
A.ТМФ - ТИАМИНМОНОФОСФАТ.
Б.ДФ или ТПФ - ТИАМИНДИФОСФАТ или ТИАМИНПИРОФОСФАТ
B.ТТФ - ТИАМИНТРИФОСФАТ.
ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК)
2.ФЛАВИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В 2.
1 .ФМН - ФЛАВИНМОНОНУКЛЕОТИД.
2.ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФАД*Н2

ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н — ОВР.
3. ПАНТОТЕИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин ВЗ (ПАНТОТЕИНОВАЯ К-ТА). KO-F A (HSK.O-A - HS КОЭНЗИМ А). КОФЕРМЕНТ АЦИЛИРОВАНИЯ.
4. НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин РР
(НИАЦИН).
1.НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД). НАД * Н2. 2.НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). НАДФ*Н2.
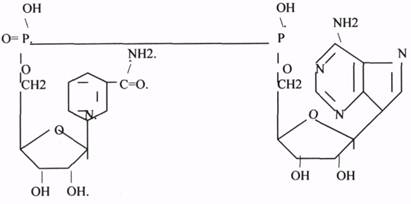
НАД и НАДФ также связаны с ферментами ДЕГИДРОГЕНАЗАМИ, которые в окислительно-восстановительных реакциях (реакции ДЕГИДРИРОВАНИЯ) - анаэробные ДГ.
5.ПИРИДОКСИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В6. ПАФ - ПИРИДОКСАМИНОФОСФАТ.
ПФ - ПИРИДОКСАЛЬФОСФАТ.Участвует в реакциях превращения АК:
1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ.
2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК.
НЕВИТАМИНЫЕ КОФРМЕНТЫ:
Не содержат в своём составе витаминов, но участвуют в каталитических превращениях.
1 .НУКЛЕОТИДЫ: АТФ, ЦТФ (синтез ФОСФОЛИПИДОВ); УДФ, УТФ, ГТФ (синтез
ГЛИКОГЕНА).
2.ПРОИЗВОДНЫЕ ПОРФИРИНА: ГЕМ, ЦИТОХРОМЫ, КАТАЛАЗА.
3.ПЕПТИДЫ:
ГЛУТАТИОН - ТРИПЕПТИД, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами ОКСИДОРЕДУКТАЗАМИ. Участвует в окислительно-восстановительных реакциях.
4.ИОНЫ РАЗЛИЧНЫХ МЕТАЛЛОВ.
| <== предыдущая страница | | | следующая страница ==> |
| Тема 9. Спонсорство | | | Лекция № 4.ФЕРМЕНТЫ (продолжение) |
Дата добавления: 2014-04-15; просмотров: 767; Нарушение авторских прав

Мы поможем в написании ваших работ!