
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Эволюционные представления и второе начало термодинамики
____________________
Из опыта мы знаем, что не существует проблемы, если мы желаем преобразовать механическую энергию в тепло. Для примера рассмотрим соскальзывание камня с горки. Сила тяжести совершает работу, камень начинает соскальзывать с горки, т.е. приобретает скорость. Трение тормозит движение камня, из-за чего повышается температура в местах соприкосновения камня и горки. тепло течет от более нагретых частей системы к более холодным и таким образом рассеивается в окружающем камень пространстве и в самом камне. В данном примере энергия механического движения преобразуется в теплоту безо всяких затруднений.
Попробуем обратить рассмотренный процесс. будем нагревать камень, надеясь, что благодаря нагреванию совершится механическая работа, т.е. камень поднимется вверх на горку. Сколько бы попыток мы не совершили, камень по-прежнему останется у основания горки. Мы видим, что в этом случае преобразование теплоты в механическую работу вызывает затруднения. Возникает вопрос – почему? Ведь такой процесс не противоречит закону сохранения энергии.
Т.е. в природе существует множество процессов, которые происходят самопроизвольно, хотя обратные процессы никогда не наблюдаются. приведем еще примеры. Чашка, стоящая на краю стола, будет разбита, если уроните ее на пол, однако сколько бы вы ни прикладывали ту же самую силу, которая привела к падению чашки, черепки никогда не соберутся снова. Духи из флакона самопроизвольно распространятся по комнате, но никогда сами по себе не соберутся опять во флакон. Интересно, что в приведенных примерах реализация обратных процессов не привела бы к нарушению закона сохранения энергии (первое начало термодинамики).
Для того чтобы объяснить отсутствие обратимости множества процессов, наблюдаемых в природе, во второй половине 19 в. был сформулирован новый закон - второе начало термодинамики. Согласно этому закону, можно судить, какие процессы возможны в природе, а какие – нет. Второе начало термодинамики можно сформулировать несколькими способами. В принципе, все они эквивалентны друг другу.
Первая формулировка принадлежит Клаузису (1822-1888): теплота в естественных условиях переходит от горячего тела к холодному, в то время как от холодного тела к горячему теплота сама по себе не переходит. Очевидно, формулировка Клаузиуса относится к процессу обмена теплотой и, с первого взгляда, не вполне ясно, как применить ее к более широкому классу процессов.
Исторически более общая формулировка была получена в ходе изучения тепловых двигателей. тепловой двигатель это любое устройство, которое преобразует теплоту в механическую работу. В таком устройстве рабочее тело обязательно получает некоторое количество теплоты Q1 от нагревателя, совершает механическую работу А и часть теплоты Q2 передает холодильнику. Термический коэффициент полезного действия h определяется формулой:
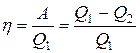
Было бы великолепно, если бы вся теплота, полученная от нагревателя, превратилась в механическую работу ( в этом случае Q2 =0). Коэффициент полезного действия такого двигателя оказался бы равным 100%! Этот двигатель получил название вечный двигатель второго рода («перпетум мобиле второго рода»). Но все попытки сконструировать двигатель, который позволял бы превратить всю теплоту, полученную от нагревателя, в эквивалентную ей механическую работу, оказались безуспешными. Т.е. такой двигатель невозможен. В связи с чем и появилась еще одна формулировка второго начала термодинамики (Кельвина -Планка): невозможен периодический процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей механическую работу.
Наиболее общая формулировка второго начала термодинамики была дана позже. Она носит название «принцип возрастания энтропии» (или «неравенство Клаузиуса»). Дадим эту формулировку без использования понятия энтропия: любые процессы, происходящие в замкнутой системе, переводят ее из более упорядоченного в более беспорядочное (хаотическое) состояние. Замкнутой системой называется такая система, которая не обменивается с окружающей средой веществом и (или) энергией.
Таким образом, второе начало термодинамики указывает направление происходящих в замкнутых системах процессов: возможны лишь такие процессы, которые приводят к возрастанию хаоса и беспорядка в замкнутых системах, к снижению уровня их организованности. Именно поэтому говорят, что второе начало термодинамики определяет термодинамическую стрелу времени. Для замкнутых систем нормальному ходу времени соответствуют процессы, приводящие к увеличению хаоса и беспорядка в этих системах.
Дадим теперь формулировку второго начала термодинамики, используя понятие «энтропия». Понятие «энтропия» сегодня настолько широко используется в научно-популярной литературе, что можно сказать: это понятие стало частью общей культуры, а не просто научным термином.
Энтропия – это физическая величина, которая характеризует степень неупорядоченности любой системы: чем больше энтропия, тем более неупорядоченное состояние занимает система; чем меньше энтропия, тем меньше в системе хаоса и беспорядка, тем более организованной она является.
В физике показано, что энтропия также характеризует отклонение системы от равновесия. Равновесному состоянию системы соответствует максимум хаоса и беспорядка. Чем более упорядоченной (другими словами, более организованной) является система, тем дальше она удалена от равновесия. Все сказанное иллюстрирует рис. 2.3.
Теперь можно дать еще одну формулировку второго начала термодинамики: при любых процессах полная энтропия замкнутой системы либо увеличивается, либо остается постоянной. (Среди физиков бытует шутка, в которой энтропия сравнивается со старой властной теткой: ее все недолюбливают, но она всегда права.)
|
|
Рис. 2.3. Иллюстрация к толкованию термина «энтропия»
Энтропию принято обозначать латинской буквой S. Если энтропия замкнутых систем может только возрастать или оставаться постоянной, это означает, что изменение энтропии D S может быть либо больше нуля, либо равно нулю. Математически эта формулировка записывается так (это и есть неравенство Клаузиуса):
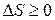
Изменение энтропии равно нулю для обратимых процессов и больше нуля во всех других случаях. Все реальные процессы, происходящие в природе, являются необратимыми.
Таким образом, второе начало термодинамики говорит о том, как изменяется степень упорядоченности любой замкнутой системы с нормальным течением времени. Понятно, что замкнутой системой может быть только неживой объект.
Рассмотрим, распространяется ли второе начало термодинамики на живые объекты. Первоначально выделим три наиболее характерные отличия живого и неживого вещества с точки зрения физики
Во-первых, любое живое существо является принципиально открытой системой, которая обменивается с окружающей средой веществом и энергией. Во-вторых, для нормальной жизнедеятельности живого организма важно, чтобы его энтропия не возрастала (соответственно степень упорядоченности не уменьшалась) в процессе жизни. Это означает, что изменение энтропии живого вещества D Sживого должно быть отрицательным или, в крайнем случае, равным нулю:  . В-третьих, любой живой организм (даже простейший) является высокоорганизованной системой, далекой от состояния теплового равновесия с окружающей средой. Каким же образом удается живой системе длительное время поддерживать свою высокую упорядоченность, свое «неравновесие» с окружающей средой?
. В-третьих, любой живой организм (даже простейший) является высокоорганизованной системой, далекой от состояния теплового равновесия с окружающей средой. Каким же образом удается живой системе длительное время поддерживать свою высокую упорядоченность, свое «неравновесие» с окружающей средой?
Для ответа на поставленный вопрос рассмотрим некоторое живое существо (например, зайца в лесу), которое для поддержания своей жизнедеятельности взаимодействует с окружающей средой (рис. 2.4). В данном случае окружающей средой является лес. Строго говоря, в окружающую среду следует добавить еще атмосферу и Солнце. «Живое» в процессе своей жизнедеятельности обменивается с окружающей средой веществом и энергией.
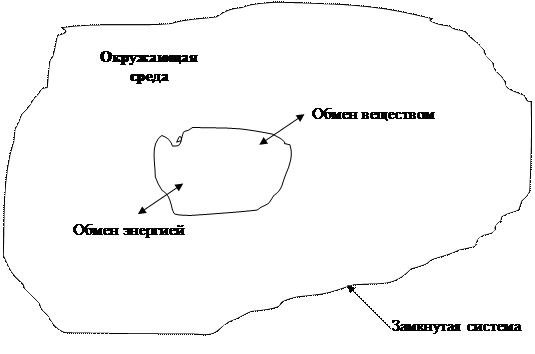
Рис. 2.4. Эволюция «живого»
Это означает, что изменение энтропии живого вещества D Sживого должно быть отрицательным или, в крайнем случае, равным нулю: 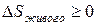 .
.
«Живое» является открытой системой. Образуем из живого существа и окружающей среды замкнутую систему, для которой должно выполняться второе начало термодинамики ( 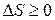 ). Изменение энтропии этой замкнутой системы складывается из изменения энтропии «живого» и изменения энтропии окружающей среды:
). Изменение энтропии этой замкнутой системы складывается из изменения энтропии «живого» и изменения энтропии окружающей среды:
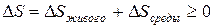 (2.3)
(2.3)
Поскольку первое слагаемое должно быть отрицательным, а сумма положительной, то достичь этого можно лишь при условии, если изменение энтропии окружающей среды будет больше нуля, да еще по модулю превосходить изменение энтропии живого:
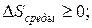
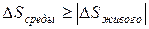 (2.4)
(2.4)
Таким образом, живой существо, являясь открытой системой, может не только поддерживать свой высокий уровень организованности, но может развиваться и совершенствоваться. Но сама жизнь, ее развитие и усложнение происходит за счет увеличения хаоса и беспорядка в окружающей среде, т.е. за счет ее разрушения.
Т.е. мы можем констатировать отсутствие фактического противоречия между реальными процессами самоорганизации живого вещества и вторым началом термодинамики.
Упорядоченность, возникающая в какой-либо части Вселенной (будь то растение, человек или животное), является преходящей. Она разрушится, когда система не сможет поддерживать отрицательное изменение энтропии (за счет притока энергии из окружающей среды), и превратится в полную неупорядоченность (смерть живого существа). Чтобы жить, мы должны «диссипировать» (рассеивать энергию), поддерживая неравновесное состояние своего организма по отношению к среде. Образно говоря, полное равновесие равнозначно смерти.
«Действительно, за все в жизни приходится платить. Мы с вами не можем существовать, ничего не азрушая... Это проклятье извечно довлеет над жизнью и обществом, составляя непременное условие человеческого бытия» [210]. Все высокоорганизованные живые существа для совершения работы против возрастания энтропии в организме вынуждены черпать энергию из других живых организмов. Грубая констатация «жить – значит разрушать» в меньшей мере относится к растениям, поскольку их основной источник энергии – самопроизвольное разрушение Солнца. Солнце – типичная звезда, которая находится в состоянии неравновесия с окружающей космической средой, и на протяжении примерно 6 млрд лет излучает в окружающее пространство поток лучистой энергии. Растения (за счет фотосинтеза) способны совершать работу против возрастания энтропии, используя эту энергию. Правда, кроме солнечной энергии, растения используют также углекислый газ, минералы и прочие ресурсы Земли. Разрушив другие живые организмы, травоядное или хищник высвобождает энергию, необходимую ему для поддержания собственного неравновесного состояния, т.е. жизни.
Гармония биогеоценозов является напряженной, она строится на острых внутренних конфликтах, главным среди которых всегда остается фундаментальное противоречие между созидательной работой живого вещества и его разрушительным эффектом. При благоприятных внешних условиях живые системы (например, популяции) проявляют естественную склонность к неограниченной экспансии, умножая разрушительные эффекты в среде, и рано или поздно наталкиваются на ограниченность ресурсов.
У живого вещества на Земле изначально ограничено жизненное пространство, запас необходимых веществ в океане, почве, атмосфере. Наложение пределов естественному стремлению жизни к неограниченной экспансии и создает необходимые предпосылки для прогрессивной эволюции живого вещества на Земле. Прогрессивные изменения живого вещества были не самоцелью, а средством выживания. Новые формы жизни осваивали пространства, непригодные для прежних форм, жизнедеятельность одних организмов строилась на использовании отходов жизнедеятельности других организмов. Множились взаимосвязанные симбиозы различных животных и растений. Происходило усложнение биосферы.
Теперь, когда мы выяснили, что прогрессивная эволюция живого вещества не противоречит законам физики, возникает другой вопрос. Почему же все-таки явления самоорганизации реально происходят? Что является причиной эволюционного процесса? Ведь постоянная утечка энергии Солнца не может являться первичной биологического, и тем более социального, развития на Земле. Наличие такой энергии это всего лишь предпосылка для самоорганизации материи. Безуспешные попытки ответить на этот вопрос привели некоторых ученых к выводу о том, что возникновение и развитие биосферы «представляет собой исключительное единичное событие, конечно, совместимое с фундаментальными законами природы, но не выводимое из них» [210].
Ответ на вопрос, что является причиной прогрессивной эволюции, что приводит к появлению высокоорганизованных форм жизни, чрезвычайно важен. От этого ответа зависит наша оценка долгосрочных перспектив социально развития, выработка стратегии и тактики преодоления глобальных кризисов, с которыми сегодня сталкивается человечество.
|
| <== предыдущая страница | | | следующая страница ==> |
| Регресс и прогресс в природе, обществе и технике | | | Причины прогрессивной эволюции |
Дата добавления: 2014-05-02; просмотров: 316; Нарушение авторских прав

Мы поможем в написании ваших работ!