
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кристаллическое строение металлов
Исследование строения металлов проводят путем изучения макроструктуры с увеличением до 10 раз и без увеличения; микроструктуры - с увеличением от 10 до 2000 раз на оптических микроскопах и до 100 000 раз на электронных микроскопах, атомной структуры - путем рентгенографического анализа.
Металлы представляют собой кристаллические тела с закономерным расположением атомов в узлах пространственной решетки. Решетки состоят из ряда кристаллических плоскостей, расположенных друг от друга на расстоянии нескольких нанометров (1 нм = 10~9м). Для железа эти расстояния 28,4 нм (а = Ее) и 36,3 нм (у = Ре). Большинство металлов имеет пространственное строение решетки в виде простых геометрических фигур, обладающих плотнейшей упаковкой, - это кубические объемно- и гра- нецентрированные и гексагональные решетки (рис. 1).
Плотность упаковки характеризуется координационным числом, представляющим собой число соседних атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем больше число, тем плотнее упаковка. Для объемно-центрированной кубической упаковки оно равно 8 (К8); гранецентрированной — 12 (К12); гексагональной - тоже 12 (К12). В кубической объемно-центрированной решетке кристаллизуются К, Ка, 1Л, а-Ре
 Мо, W, V, Сг, Ва и др.; кубической гранецентрированной - М, А&, Аи, Ри Си, у - Бе; в гексагональной -Сс1, Яд, Ве, а-Тл, си-2п и др
Мо, W, V, Сг, Ва и др.; кубической гранецентрированной - М, А&, Аи, Ри Си, у - Бе; в гексагональной -Сс1, Яд, Ве, а-Тл, си-2п и др
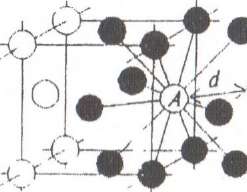 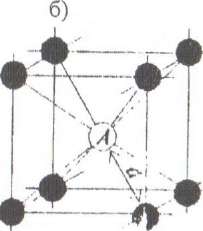 Рис. 1. Плотность упаковки кристаллических решеток: а) кубической гранецентрированной (К12); б) объемно-центрированной (К8); в) гексагональной (К12)
Рис. 1. Плотность упаковки кристаллических решеток: а) кубической гранецентрированной (К12); б) объемно-центрированной (К8); в) гексагональной (К12)
|
| Рис. 2. Кривые охлаждения и нагревания железа |
Расстояние между центрами ближайших атомов в решетке называется периодом решетки. Период решетки для большинства металлов находится в пределах 0,1-0,7 им.
Отдельные участки кристаллической решетки прочно связаны между собой в комплексы - зерна. Взаимное расположение зерен отдельных элементов и сплавов определяет структуру металлов и их свойства.
Атомы металлов характеризуются малым количеством электронов (1...2) на наружной оболочке, легко отдают их, что подтверждается высокой электропроводностью.
Многие металлы в зависимости от температуры претерпевают структурные изменения кристаллической решетки.
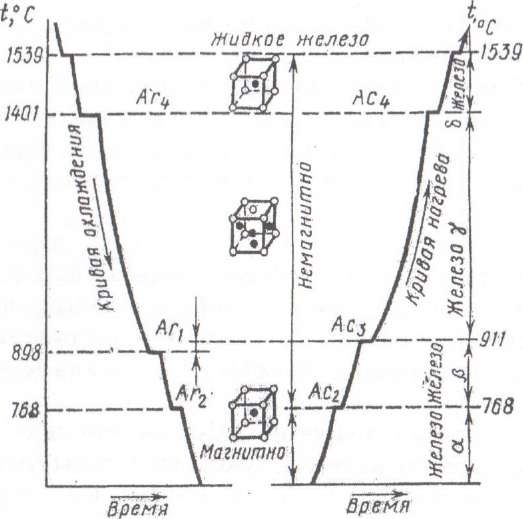
Железо, олово, титан и другие металлы обладают свойствами аллотропии, т. е. способностью одного и того же элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Железо имеет четыре аллотропические формы: а-Ре, р-Ре, у-Ре, 5-Ре. Практическое значение имеют а-Ре и у-Ре, так как р-Ре и 8-Ре отличаются от а-Ре только величиной межатомного расстояния, а для Р~Ре характерно отсутствие магнитных свойств.
Температура, при которой происходит переход металла из одного аллотропического вида в другой, называется критической. Величины этих температур видны на диаграмме охлаждения и нагревания чистого железа (рис. 2) в виде участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты при нагревании. До точки Кюри (768 °С) железо магнитно, выше – немагнитно
Все металлы находятся в твердом состоянии до определенной температуры. При нагреве металла амплитуда колебания атомов достигает некоторой критической величины, при которой происходят разрушение кристаллической решетки и переход металлов из твердого состояния в жидкое. Процесс кристаллизации заключается в росте кристаллов путем отложения новых кристаллических групп вокруг возникших зародышей. Рост кристаллических образований происходит в определенных направлениях. Вначале образуются главные оси кристалла путем роста в трех взаимно перпендикулярных направлениях, а затем от каждой из этих осей образуются новые и возникает не полностью завершенный кристалл, называемый дендритом. В дальнейшем все промежутки между осями дендрита заполняются утюрядоченно расположенными атомами.
В условиях несвободной кристаллизации образующиеся кристаллы получают неправильные очертания и форму и называются кристаллитами или зернами. Величина зерен оказывает существенное влияние на механические свойства металлов: чем мельче зерна, тем прочнее металл.
Технические металлы и сплавы представляют собой поликристаллические тела, состоящие из большого числа различно ориентированных кристаллических зерен (поперечные размеры зерен 0,001-0,1 мм), поэтому в целом металлы принято считать условно изотропными телами.
Однако при одинаковой ориентации кристаллитов такой мнимой изотропности наблюдаться не будет. Кристаллическая решетка реальных металлов и сплавов далека от идеального строения
В реальных кристаллах всегда имеются дефекты, которые подразделяют на точечные, линейные, поверхностные и объемные. Размеры точечного дефекта близки к межатомному расстоянию. У линейных дефектов длина на несколько порядков больше ширины; у поверхностных дефектов мала толщина, а ширина и длина больше толщины на несколько порядков. Объемные дефекты (поры, трещины) имеют значительные размеры во всех трех направлениях.
Дефекты сохраняют подвижность, способны перемещаться в кристаллической решетке и при сближении взаимодействуют между собой. В большинстве случаев подвижность дефектов контролируется диффузией. Передвижение дислокаций под действием напряжений не связано с массопереносом, дислокации подвижны и при низких температурах, когда диффузия уже не играет никакой роли.
К самым простым точечным дефектам относятся вакансии, меж- узельные атомы основного вещества, чужеродные атомы внедрения (рис. 3).
Вакансией называется пустой узел кристаллической решетки, а меж- узелъным атомом - атом, перемещенный из узла в позицию между узлами.
а) б) в)
 Рис. 3. Точечные дефекты в кристаллической решетке: а) вакансии; б) межузельный атом; в) примесный атом внедрения
Рис. 3. Точечные дефекты в кристаллической решетке: а) вакансии; б) межузельный атом; в) примесный атом внедрения
|
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при 20-25 °С содержится КГ13 % (ат.) вакансий, а вблизи точки плавления - уже 0,01 % (ат.) (одна вакансия приходится на 104 атомов).
Пересыщение точечными дефектами происходит при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. В последнем случае концентрация вакансий и межузельных атомов одинакова: выбитые из узлов решетки атомы становятся межузельными атомами, а освободившиеся узлы становятся вакансиями.
С течением времени избыток вакансий сверх равновесной концентрации уничтожается на свободных поверхностях кристалла, порах, границах зерен и других дефектах решетки. Места, где исчезают вакансии, называются стоками вакансий. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов (диффузия, спекание порошков и т. д.).
Все виды точечных дефектов искажают кристаллическую решетку и в определенной мере влияют на физические свойства, преимущественно на электропроводность, магнитные свойства. На механические свойства металлов точечные дефекты практически не влияют.
Важнейшие виды линейных несовершенств - краевые и винтовые дислокации (рис. 4). Краевая дислокация в сечении представляет собой край «липшей» полуплоскости в решетке (см. рис. 4, а). Вокруг дислокаций решетка упруго искажена
а) б) в)
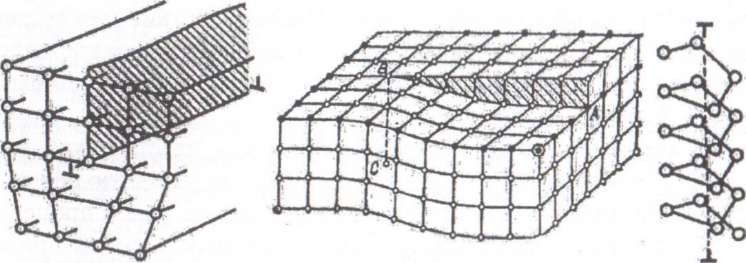 Рис. 4. Схемы краевой (а) и винтовой (б) дислокаций, вектора Бюргенса (в)
Рис. 4. Схемы краевой (а) и винтовой (б) дислокаций, вектора Бюргенса (в)
|
Мерой искажения служит так называемый вектор Бюргенса (рис. 4, в).
Краевые, или линейные, дислокации характеризуются появлением в кристалле добавочной незавершенной атомной плоскости (электроплоскости). Дислокация называется положительной (рис. 4, а), если экстраплоскость лежит в верхней части кристалла, и отрицательной, если она расположена в нижней части кристалла.
Винтовая дислокация (рис. 4, б) появляется, если в кристалле сделать надрез и сдвинуть вниз одну часть кристалла относительно другой на одно межатомное расстояние (на рис. 4, б плоскость сдвига заштрихована). Как видно из рисунка, смещение уменьшается от точки А к точке В, что вызывает изгиб атомных плоскостей. Несовершенная область вокруг линии ВС называется винтовой дислокацией, так как после появления такого несовершенства атомные плоскости кристалла закручиваются подобно винтовой лестнице
К поверхностным дефектам относят болыпеугольные и малоугольные границы, дефекты упаковки, границы двойников.
Поликристаллический сплав содержит большое число мелких зерен, границы между которыми представляют переходный слой шириной 1-5 нм. В нем нарушена правильность расположения атомов, имеющая скопления дислокаций, повышена концентрация примесей. Если соответствующие кристаллографические направления в соседних зернах образуют углы в десятки градусов, то такие границы называют болыиеуголъными. Если же такой угол невелик (не более 5°), то такие границы называют малоуголъными.
Дефект упаковки - это часть атомной плоскости, ограниченной дислокациями, в пределах которой нарушен нормальный порядок чередования атомных слоев.
Поверхностные дефекты влияют на механические и физические свойства металлов. Чем мельче зерно, тем выше предел текучести, вязкость и меньше опасность хрупкого разрушения.
Диффузия протекает значительно быстрее вдоль границ зерен, чем сквозь кристаллы, особенно при нагреве. Взаимодействие между дефектами, перемещение их в кристаллах отражается на свойствах материалов.
К объемным дефектам в кристаллах относят микротрещины в них, поры и различные включения.
Дислокации играют главную роль в процессах пластической деформации металлов, они в значительной мере определяют их реальную прочность.
Дефекты кристаллического строения возникают уже в процессе кристаллизации металла. Взаимодействие дефектов между собой приводит к образованию новых несовершенств и, как следствие, к изменению таких свойств металлов, как прочность и пластичность. При этом с возрастанием плотности дислокаций реальная прочность металла может проходить через минимум, так как дислокации из параллельных друг другу могут переходить в расположенные в разных плоскостях и направлениях. Последние дислокации, мешая друг другу перемещаться, будут увеличивать прочность металла и снижать его пластичность (явление наклепа). На этом основано упрочнение металлов путем термической обработки, сопровождающееся измельчением зерна и изменением кристаллической решетки.
2.2. Строение металлических сплавов
Металлическими сплавами называют вещества, образованные двумя или несколькими металлами или металлы с неметаллическими элементами и химическими соединениями, обладающие металлическими свойствами. Большинство сплавов получают сплавлением, т. е. соединением компонентов сплава в жидком состоянии. Однако сплавы могут быть получены спеканием, электролизом и другими способами. 10
При изучении сплавов пользуются рядом специальных терминов, таких как «система», «фаза» и «компонент».
Системой принято называть группу сплавов, выделяемую для изучения. Понятия «система "медь - никель"» или «система "свинец - сурьма"» означают, что для исследования берутся сплавы с различной концентрацией, образованные в первом случае медью с никелем, а во втором - свинцом и сурьмой.
Фазой называют однородную по химическому составу, строению и свойствам часть системы. В сложных системах, состоящих из нескольких фаз, фазы должны иметь границы раздела, при переходе через которые изменяются состав, строение и свойства сплава.
Компонентами называют вещества, образующие систему. Компонентами могут быть чистые металлы, неметаллы или устойчивые химические соединения. Например, в сплавах железа с углеродом компонентами могут быть железо и карбид железа Ре3С. В этом случае мы будем иметь систему сплавов Ре-Ре3С.
В результате совместной кристаллизации нескольких элементов могут образоваться сплавы следующих типов: механическая смесь, твердый раствор и химическое соединение. Возможность возникновения того или иного типа сплава определяется характером взаимодействия элементов в процессе кристаллизации.
Механические смеси образуются путем срастания кристаллов между собой при раздельной кристаллизации компонентов. В механической смеси каждый из компонентов сохраняет свои специфические свойства. Структура сплава в этом случае будет состоять из кристаллов веществ А и Б, связь между которыми осуществляется по границам зерен. Значения свойств сплава могут быть средними между свойствами элементов, которые его образуют.
Твердые растворы (рис. 5) образуются в результате проникновения в кристаллическую решетку основного металла атомов другого металла или неметалла. В зависимости от характера размещения атомов различают твердые растворы замещения и внедрения. При образовании твердого раствора замещения атомы одного из компонентов, например Б, частично замещают атомы компонента А в узлах его кристаллической решетки. Твердый раствор внедрения образуется, когда атомы одного из компонентов размещаются в междоузлиях кристаллической решетки другого (рис. 5, в). Твердые растворы замещения могут образоваться при совместной кристаллизации металлов, а твердые растворы внедрения - при совместной кристаллизации металла с неметаллом. Твердые растворы принято обозначать буквами греческого алфавита а, |3, у ит. п.
| Л Атомы т" растворителя -ф» Атомы растворимого вещества |
В растворе внедрения атомы растворимого элемента внедряются между атомами металла, искажая его решетку. К таким элементам относятся углерод, водород, азот, бор и другие, концентрация которых в твердом растворе может составлять 1—2 %. В растворе замещения атомы растворимого элемента занимают места атомов растворителя в кристаллической решетке. При этом размеры атомов основного металла и примеси должны отличаться не более чем на 15 %, например, хорошо замещаются атомы Бе и Сг, Си и Т1 и V и т. д.

|
| Рис. 5. Схема твердого раствора: а) замещения неупорядоченного; б) замещения упорядоченного; в) внедрения |
Химические соединения образуются в результате химического взаимодействия компонентов, при этом атомы располагаются в строгом порядке и количественном соотношении. Например, в сплавах железа с углеродом образуется карбид железа, называемый цементитом: ЗРеС + С = Ре3С. В сплавах алюминия с медью образуется интерметаллическое соединение СиАЬ. Как БезС, так и СиА12 - твердые, прочные, но очень хрупкие при разрушении вещества. Наличие их в сплаве ведет к его упрочнению с одновременным снижением пластичности и ударной вязкости
2.3. Диаграмма состояния двойных сплавов
Строение сплава определяет его свойства, поэтому важно знать, как это строение будет меняться при изменении температуры и состава сплава. Зависимость между строением сплава, его составом и температурой описывается при помощи диаграмм состояния.
Диаграммы состояния строятся экспериментально по критическим точкам, полученным на кривых охлаждения сплавов данной системы. Поскольку эти диаграммы не содержат фактора времени и критические точки стремятся получить при очень медленном нагреве или охлаждении сплава, т. е. для равновесного состояния, диаграммы состояния называются еще и диаграммами равновесия.
Зависимость между составом, структурой и характером диаграмм состояния впервые установил Н. С. Курнаков.
Вид диаграммы состояния двойной системы определяется взаимодействием ее компонентов в жидком и твердом состоянии (образованием жидких и твердых растворов, химических соединений и промежуточных фаз), а также наличием полиморфных модификаций компонентов. Можно выделить несколько основных типов диаграмм состояний сплавов, образующих:
1) гетерогенные структуры;
2) твердые растворы с неограниченной или ограниченной растворимостью компонентов в твердом состоянии;
3) химические соединения.
Диаграммы состояния сплавов 1-го типа. Компоненты таких сплавов неограниченно растворяются один в другом в жидком состоянии и не растворяются в твердом, например, свинец (РЬ) + сурьма (БЬ) (см. рис. 6).
а) б)
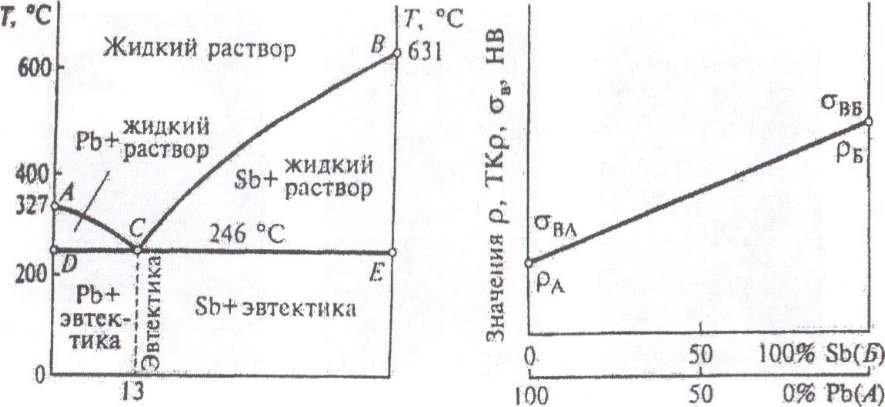 Рис. 6. Диаграмма состояния сплава 1-го типа (а) и изменение физико-химических свойств в зависимости от состава сплава (б)
Рис. 6. Диаграмма состояния сплава 1-го типа (а) и изменение физико-химических свойств в зависимости от состава сплава (б)
|
Кривая АСВ отвечает началу затвердения всех сплавов и называется температурой ликвидуса (от лат. Цдшёив - жидкий). Прямая ВСЕ соответствует концу затвердения сплавов и называется температурой солидуса (от лат. воБёш - твердый). Выше линии ликвидуса все сплавы этой системы (РЬ - БЬ или в общем виде А + Б) находятся в жидком состоянии и образуют раствор. Ниже этой линии имеется жидкий раствор плюс кристаллы РЬ (ниже линии АС) и кристаллы БЬ (ниже линии СБ). Таким образом, по линии АС из жидкого раствора кристаллизуется компонент А (РЬ), образуя а -фазу, а по линии СВ - компонент Б (ЭЬ), образуя (3 -фазу. В чистом виде РЬ начинает кристаллизоваться при температуре 327 °С, БЬ - 631 °С; у сплавов эти температуры ниже. Твердый сплав, состав которого отвечает точке С, имеет гетерогенную структуры и представляет собой механическую смесь двух твердых фаз (а - и (3-фазы) в определенных соотношениях друг с другом и одновременно кристаллизующихся из жидкого раствора. Для системы сплавов РЬ — 8Ь соотношение компонентов в точке С составляет 87 % РЬ и 13 % 8Ь. Такую двухкомпонентную структуру называют эвтектикой (от греч. еЩекШБ — легко плавящаяся или хорошо плавящаяся), сплав - эвтектическим, температуру, при которой образуется этот сплав, — эвтектической температурой, а состав сплава — эвтектическим составом.
Сплавы, лежащие левее эвтектической точки С (на линии ВС и ниже ее), называют доэвтектическими сплавами. После затвердевания они имеют структуру, состоящую из кристаллов БЬ и эвтектики (87 % РЬ + 13 % БЬ). Структура доэвтектического, эвтектического и заэвтектического сплавов
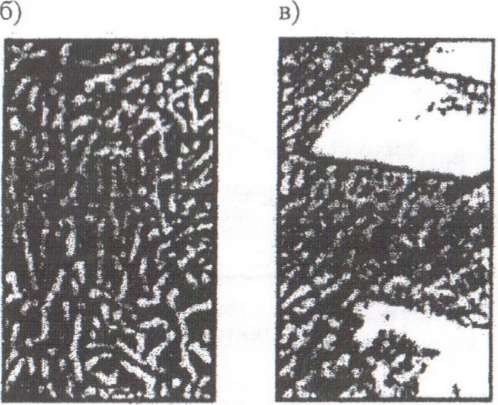 Рис. 7. Структура сплавов системы РЬ - БЬ (увеличение 1:250): а) доэвтектический сплав: 94 % РЬ + 6 % БЬ (темные кристаллы РЬ + эвтектика); б) эвтектический сплав: 87 % РЬ +13 % 8Ь; в) заэвтектический сплав: 60 % РЬ + 40 % БЬ (светлые кристаллы 8Ь + эвтектика)
Рис. 7. Структура сплавов системы РЬ - БЬ (увеличение 1:250): а) доэвтектический сплав: 94 % РЬ + 6 % БЬ (темные кристаллы РЬ + эвтектика); б) эвтектический сплав: 87 % РЬ +13 % 8Ь; в) заэвтектический сплав: 60 % РЬ + 40 % БЬ (светлые кристаллы 8Ь + эвтектика)
|
Свойства сплавов гетерогенных структур изменяются линейно от свойств компонента А к свойствам компонента Б (рис. 6, б).
Диаграммы состояния 2-го типа. Твердые растворы замещения могут иметь неограниченную и ограниченную растворимость компонентов.
Если в сплавах (рис. 8) образуется непрерывный ряд твердых растворов, то свойства изменяются по криволинейному закону, например, медь (Си) + + никель (N1).
В интервале температур Г, - Т2 образуются кристаллы, неоднородные по химическому составу. Неоднородность состава внутри кристалла называют внутрикристаллитной ликвацией. Концентрация компонентов по объему кристалла выравнивается в результате диффузии атомов при воздействии высокой температуры; при максимальном искажении кристаллической решетки увеличивается твердость (НВ), механическая проч ность (ств) и удельное электрическое сопротивление р, температурный же коэффициент удельного сопротивления (ТКр) становится минимальным
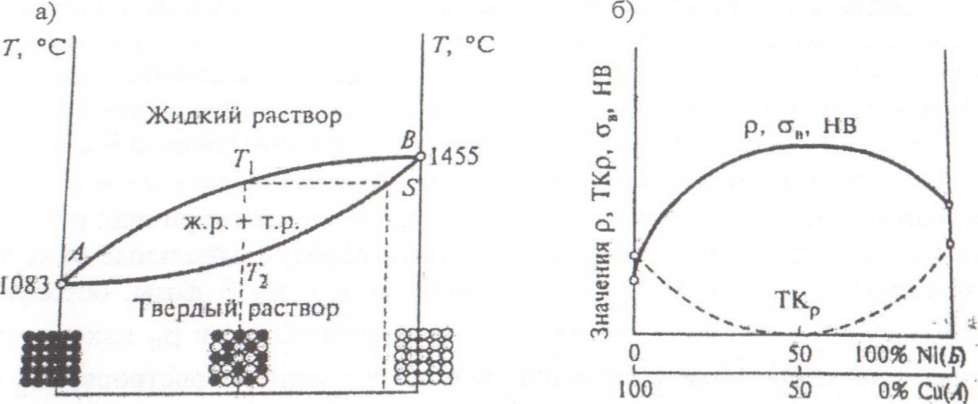 Рис. 8. Диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью компонентов: а) расположение атомов Си (черные) н № (белые) в решетках сплавов и б) изменение физико-химических свойств в зависимости от состава
Рис. 8. Диаграмма состояния сплавов, образующих твердые растворы с неограниченной растворимостью компонентов: а) расположение атомов Си (черные) н № (белые) в решетках сплавов и б) изменение физико-химических свойств в зависимости от состава
|
Диаграмма состояния сплавов, образующих твердые растворы с ограниченной растворимостью компонентов, представлена на рис. 9
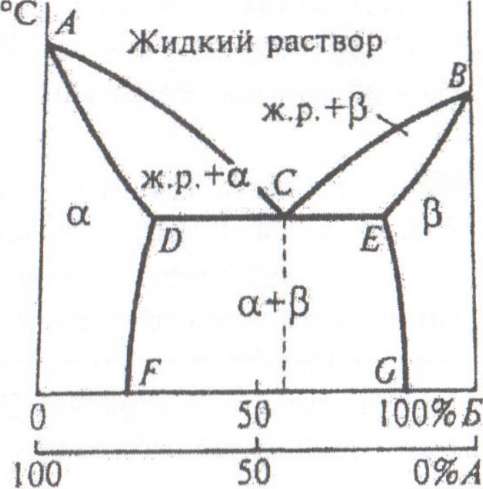 Рис. 9. Диаграмма состояния сплавов в упрощенном виде для твердых растворов с ограниченной растворимостью компонентов
Рис. 9. Диаграмма состояния сплавов в упрощенном виде для твердых растворов с ограниченной растворимостью компонентов
|
Твердые растворы а - и (3 -фазы с максимальной концентрацией растворимого компонента образуются между линиями ликвидуса и солидуса
В этих областях а- и р- фазы находятся вместе с жидким раствором. На линии ВСЕ сплавы затвердевают и образуют механическую смесь кристаллов а -твердого раствора и Р -твердого раствора.
Эвтектический сплав образуется в точке С. Сплавы, располагающиеся слева от эвтектического состава (левее точки С) и имеющие концентрацию компонентов в пределах точек I) и С, называются доэвтектическими, а справа от точки С - в пределах точек С и Е, — заэвтектическими.
С понижением температуры растворимость компонента Б в а -фазе и компонента А в Р -фазе все время снижается. В результате а - и Р -твердые растворы становятся пересыщенными, и происходит вторичная кристаллизация: компонент Б выделяется из а -фазы, образуя отдельные кристаллы, называемые вторичными (Рц), а компонент А - из Р-фазы, образуя вторичные кристаллы (ап). Эти вторичные кристаллы <хп и Рп находятся не в структурно свободном состоянии, а в виде твердого раствора; ап - это твердый раствор А в Б, а рц - твердый раствор Б в А. Таким образом, при понижении температуры на линии ВЛ выделяются вторичные кристаллы Рц, а на линии Ев - вторичные кристаллы ап. Следовательно, в левой области диаграммы состояния образуется гетерогенная структура, представляющая механическую смесь кристаллов твердого раствора ос и вторичных кристаллов Ри, а в правой - гетерогенная структура из смеси кристаллов Рц + ССц .
В доэвтектических сплавах (ниже линии ВС) при охлаждении из а -фазы выделяется р -фаза и образуется гетерогенная структура (конгломератного типа), состоящая из эвтектики плюс а - и р -фаза. В заэвтектических сплавах выделяется ап -фаза и образуется гетерогенная структура из эвтектики плюс Р - и аи -фаза.
У этих типов сплавов в той части, где имеют место однофазные области твердых растворов (области а- и р-фазы), физико-химические свойства (твердость, механическая прочность, удельное электрическое сопротивление и др.) проявляют криволинейную концентрационную зависимость, как это наблюдалось у сплавов, образующих твердые растворы с неограниченной растворимостью компонентов в твердом состоянии. В двух фазных областях свойства изменяются аддитивно, как это наблюдалось у сплавов, образующих гетерогенные структуры.
Таким образом, в области, ограниченной линией ЛВЕС, существует эвтектика (а+р) и избыточные кристаллы: слева а и (Рп), справа р (и ап).
Диаграмма состояния сплавов 3-го типа. Диаграмма состояния этих сплавов, компоненты которых образуют устойчивые химические соединения, представлена на рис. 10.
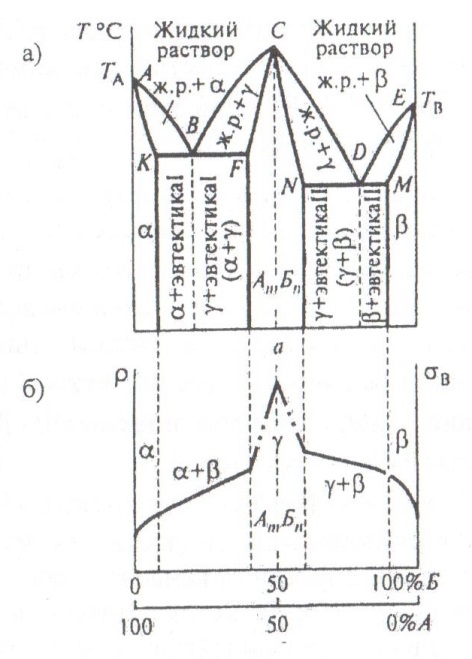
Рис. 10. Диаграмма состояния сплавов, образующих химические соединения (а); изменение физико-химических свойств в зависимости от состава в общем виде (б)
Сплавы, образующие химические соединения одного металла с другим, называются интерметаллидами.
Устойчивое химическое соединение АтБл, состоящее из химических элементов А и Б, является по существу самостоятельным веществом - компонентом, который может образовывать сплавы с каждым из входящим в него элементов (А и Б).
Диаграмму состояния сплавов, в которых присутствует устойчивое химическое соединение АтБл, можно разделить на две части, фактически на две самостоятельные диаграммы состояния (см. рис. 10).
В месте соединения двух диаграмм можно выделить точку перелома или острие вершины - точку С, соответствующую концентрациям компонентов А и Б, при которых образуется устойчивое химическое соединение АтБп. Эту точку (С) называют сингулярной. Одна часть диаграммы (левая) характеризует сплавы, образуемые компонентом А и компонентом химического соединения АтБп (область А-АтБп). Правая часть диаграммы характеризует сплавы, образуемые Б и АтБл (область В-АтБп). При этом в левой области нет компонента Б, а в правой - А. Сплавы каждой части диаграммы представляют собой сплавы с ограниченной растворимостью в твердом состоянии и образуют соответствующие эвтектики (эвтектику I и эвтектику II).
Гамма-фаза - это сплавы, образующие твердые растворы, состоящие из вещества АтБ„, в котором частично растворены химические элементы А и Б, образовавшие вещество АтБл. При этом слева от пунктирной перпендикулярной линии, опущенной из точки С, в АтБл растворен компонент А, а справа - компонент Б; а -фаза - это твердый раствор компонента Б в А, Р -фаза - это твердый раствор компонента А в Б.
В точке В образуется эвтектика I - механическая смесь а - и у -фазы. Слева от точки В и ниже линии КБ образуется механическая смесь, состоящая из а -фазы плюс эвтектика I ( а + у ), справа от точки В и ниже линии ВЛ - механическая смесь, состоящая из у-фазы плюс эвтектика I (а+у). В точке О (собственно по всей линии МЭМ) образуется эвтектика П (р+у). Слева точки £> образуется механическая смесь, состоящая из у-фазы плюс эвтектика П (р + у), а справа точки И - смесь из Р -фазы плюс эвтектика II (Р+у).
Физико-химические свойства сплавов (твердость, удельное электрическое сопротивление и др.) в зависимости от концентрации элементов А и Б изменяются неравномерно (см. рис 10, б). Когда образуются сплавы - твердые растворы, свойства проявляют криволинейную концентрационную зависимость; когда образуются сплавы - гетерогенные структуры, - аддитивную зависимость. Составу, образующему сплав - химическое соединение АтБ„, соответствует экстремум изменения физико-химических свойств.
Если компоненты А и Б при определенных соотношениях образуют друг с другом несколько явно выраженных устойчивых химических соединений, то на кривой зависимости удельного электрического сопротивления р наблюдаются несколько сингулярных точек, каждая из которых соответствует новому химическому соединению. Между этими точками свойства сплавов изменяются линейно или криволинейно, в зависимости от типа образующихся сплавов.
 Химические соединения обладают свойствами, обычно резко отличающимися от свойств образующих их компонентов. Например, химические соединения металлов с углеродом - карбиды и азотом - нитриды имеют очень высокую твердость, но хрупки при разрушении.
Химические соединения обладают свойствами, обычно резко отличающимися от свойств образующих их компонентов. Например, химические соединения металлов с углеродом - карбиды и азотом - нитриды имеют очень высокую твердость, но хрупки при разрушении.
Установлено, что чем больше интервал кристаллизации, тем больше склонность сплавов к образованию ликваций, рассеянной пористости и трещин в отливках. Лучшими литейными свойствами обладают эвтектические сплавы. Они лучше обрабатываются резанием, дают большую чистоту обработки поверхности. Однофазные сплавы (твердые растворы) лучше деформируются как в горячем, так и в холодном состоянии.
| <== предыдущая страница | | | следующая страница ==> |
| Классификация металлов и сплавов | | | Методы механических испытаний металлов и сплавов |
Дата добавления: 2014-07-14; просмотров: 1188; Нарушение авторских прав

Мы поможем в написании ваших работ!