
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Обмен белков и аминокислот. Метаболизм нуклеопротеидов и нуклеиновых кислот
1.Общая схема источников и путей расходования аминокислот в тканях.
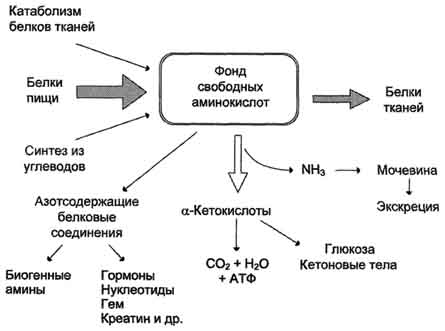 Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Аминокислотный фонд в клетке зависти от поступления и расходования свободных аминокислот. Существует три основных пути поступления свободных аминокислот в аминокислотный фонд клетки:
Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Аминокислотный фонд в клетке зависти от поступления и расходования свободных аминокислот. Существует три основных пути поступления свободных аминокислот в аминокислотный фонд клетки:
-аминокислоты, образовавшиеся при переваривании белков и доставленные из кишечника
- аминокислоты, синтезированные из метаболитов углеводного и липидного обменов
- аминокислоты, образовавшиеся при протеолизе клеточных (тканевых) белков
Основным источником аминокислот эндогенного происхождения является распад тканевых белков. Причины разрушения белков тканей связаны со старением клеток или их повреждением и денатурацией белка различными внешними и внутренними факторами. В клетке аминокислоты могут расходоваться для синтеза белков и биологический активных соединений, взаимопревращаться и разрушаться до конечных метаболитов. Наиболее активно используют аминокислоты печень и почки и менее активно головной мозг.
2. Пищевые белки как источник азота.
Белки являются незаменимым компонентом пищи. В отличие от белков - углеводы и жиры не являются незаменимыми компонентами пищи. Ежесуточно потребляется около 100 граммов белков взрослым здоровым человеком. Пищевые белки – это главный источник азота для организма. В смысле экономическом белки являются самым дорогим пищевым компонентом. Поэтому очень важным в истории биохимии и медицины было установление норм белка в питании.
В опытах Карла Фойта впервые были установлены нормы потребления пищевого белка - 118г/сутки, углеводов - 500г/сутки, жиров 56г/сутки. М.Рубнер первым определил, что 75% азота в организме находится в составе белков. Он составил азотистый баланс (определил, сколько азота человек теряет за сутки и сколько азота прибавляется).
3.Переваривание белков и всасывание аминокислот.
Протеолиз начинается в желудке и заканчивается в тонком кишечнике. В желудке белки перевариваются под воздействием пепсина, который вырабатывается в виде пепсиногена главными клетками слизистой оболочки желудка. Под воздействием соляной кислоты, которая продуцируется в обкладочных клетках желудочных желез, от пепсиногена с N-конца отщепляется полипептид из 42 аминокислотных остатков, состоящий их остаточного пептида и ингибитора пепсина и он превращается в активный пепсин:
Hcl
пепсиноген пепсин + ингибитор пепсина + полипетид
Превращение пепсиногена в пепсин может происходить и аутокаталитически:
пепсиноген пепсин + ингибитор пепсина + полипептид
пепсин
Пепсин, как фермент из класса гидролаз, вызывает гидролиз внутренних пептидных связей в молекуле белка, образованных карбоксильными группами ароматических аминокислот (фенилаланин, тирозин и триптофан). В желудочном соке детей функцию пепсина выполняет гастриксин, имеющий оптимум рН около 3,5. Гастриксин гидролизует пептидные связи, образованные дикарбоновыми аминокислотами. В кишечник из поджелудочной железы поступают в неактивном виде, в виде проферментов: трипсиногена, химотрипсиногена, прокарбоксипептидаз А и В, проэластазы. Ключевым процессом активирования всех проферментов является образование трипсина из трипсиногена под воздействием кишечной энтерокиназы. Механизм активирования трипсиногена заключается в гидролизе одной из N-концевой пептидной связи и отрыве гексапептида, называемого ингибитором трипсина. Если произойдет активация трипсиногена непосредственно в поджелудочной железе, то это вызовет протеолиз белков поджелудочной железы, что приведет к панкреатиту. Трипсин, разрывая пептидные связи в остальных проферментах, образует активные формы химотрипсина, карбоксипептидаз и эластазу. Активный трипсин гидролизует пептидные связи в молекуле белка образованные карбоксильными группами лизина и аргинина. Химотрипсин гидролизируют связи образованные тирозином,фенилаланином и триптофаном. Эластазагидролизует пептидные связи в полипептидах, где находится пролин. Карбоксипетидазы (А и В),отщепляют от полипептидных цепей С-концевые аминокислоты. Аминопептидазы кишечного сока гидролизуют N-концевые пептидные связи, отщепляя N-концевые аминокислоты. Аминонопептидазы активируются цинком или марганцем и цистеином. Дипептидазы кишечного сока (активируются кобальтом, марганцем и цистеином) гидролизует дипептиды до свободных аминокислот.
Под воздействием всех протеолитических ферментов желудочно-кишечного тракта белки пищи разрушаются (перевариваются) до аминокислот.Всасывание аминокислот активный, энергозависимый процесс и требует необходимого градиента ионов натрия, создаваемого за счет Na+,K+-АТФ-азой.
Существует не менее пяти специальных систем переносчиков аминокислот: для нейтральных алифатических, для циклических, для кислых, для основных и для иминокислот. Считается, что существует также специальнаягамма-глутаминилтрансферазнаясистема транспорта всех аминокислот, кофактором которой служит глутатион. В кишечнике возможно всасывание небольших количеств дипептидов. Всасываются они путем пиноцитоза и внутри клетки гидролизуютсяпротеиназами лизосом. У новорожденных вследствие низкой протеолитической активности ферментов пищеварительных соков и высокой проницаемости мембран клеток слизистой оболочки кишечника возможно всасывание нативных белковых молекул и их фрагментов, что может вызвать повышенную чувствительность к ним организма и явиться причиной пищевой аллергии.Наиболее активно используют аминокислоты печень и почки и менее активно головной мозг. У новорожденных и детей раннего возраста клеточные барьеры более проходимы и поэтому даже в головной мозг аминокислоты поступают очень быстро.
Метаболизм аммиака. Основные источники аммиака и пути его обезвреживания.
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС.
Аммиак образ-ся в ходе следующ.реакций:
-при дезаминировании аминок-т
-при дезаминировании биогенных аминов
- придезаминировании пуриновых оснований
- при распаде пиримидиновых оснований.
В тканях аммиак находится в виде ионов аммония. В норме в крови ур.аммиака равен 24-40мкмоль/л. При повышении уровня аммиака pH внутренней среды организма меняется и оказывает свое токсическое влияние особенно на нервные клетки, которое проявляется рвотой, потерей сознания, судорогами. Поэтому в тканях существуют механизмы обезвреживания аммиака, которое происходит след.путями:
-образованием аммониевых солей
-образованием мочевины
-образованием амидов аминок-т – аспарагина и глутамина
-восстановительным аминированием кеток-т.
Образование амидов аспарагиновой и глутаминовой аминокислот (аспарагина и глутамина) является важным вспомогательным путем связывания аммиака. Этот процесс особенно важен для нервной ткани.
СООН АДФ + Рн СОNН2 СООН
| | |
(СН2)2 NH3 + АТФ (СН2)2 +НОН (СН2)2
| | | + NH3
СН-NH2 глутамин СН-NH2 глутаминаза СН-NH2
| синтетаза | |
СООН СООН СООН
глутамат глутамин глутамат
Глутамин и в меньшей степени аспарагин являются своеобразной транспортной формой аммиака.Током крови глутамин доставляется в почки, где подвергается гидролитическому разрушению глутаминазой почек. Аналогично аспарагиназой разрушается аспарагин.
Образующийся в почках аммиак используется для нейтрализации кислот.
Основным и наиболее важным путем обезвреживания аммиака является образование мочевины.
Кребс и Гензенлейт установили, что синтез мочевины представляет собой циклический процесс, в котором каталитическую роль играет орнитин.
На первой стадии этого процесса из аммиака и углекислого газа синтезируется карбомоилфосфат:
АДФ NH2
АТФ /
СО2 + NH3 С=О
Карбомоилфосфат \
синтетаза 1 О-РО3Н2
карбомоилфосфат
Далее карбомоильная группа с помощью фермента орнитин-карбомоилтрансферазы переносится на орнитин образуется цитруллин,
• NH2 Н3РО4 NH2
• NH2 / /
• | + С=О С=О
• СН2 \ транскарбомоилаза \
• | О-РО3Н2 NH
• (СН2)2 |
• | СН2
• СН-NH2 |
• | (СН2)2
• COOH |
• орнитин СН-NH2
• |
• COOH
• Цитруллин
•
Под воздействием аргининосукцинат-лиазы аргининосукцинат разрушается на аргинин и фумарат
NH2 СООН АМФ + Н3РО4 NH СООН
/ | // | NH
С=О + СН2 АТФ С- NH-CН //
\ | \ | С-NH2
NH СН-NH2 синтетаза NH СН2 \ СООН
| | | | NH + |
СН2 COOH СН2 СООН лиаза | СН
| аспартат | СН2 ||
(СН2)2 (СН2)2 | СН
| | (СН2)2 |
СН-NH2 СН-NH2 | СООН
| | СН-NH2 Фумарат
COOH COOH |
Цитруллин Аргининосукцинат COOH
Аргинин
Далее аргинин гидролизуется аргиназой с образованием орнитина и мочевины.
NH
// NH2
С-NH2 |
\ NH2 СН2
NH / |
| + НОН С=О + (СН2)2
СН2 \ |
| аргиназа NH2 СН-NH2
(СН2)2 мочевина |
| COOH
СН-NH2 орнитин
|
COOH
аргинин
Конечные продукты азотистого обмена: соли аммония и мочевина.
Характерные для аминок-т пути катаболизма , приводят к образованию конечных продуктов азотистого обмена, образование которых идет из токсичного аммиака и из безазотистых остатков аминок-т. К конечным продуктам азотистого обмена относятся: вода, углекислый газ, мочевина, аммониевые соли, креатинин, индикан, уробилин.
Мочевина–это конечный продукт азотистого обмена. За сутки в печени синтезируется 25-30 грамм мочевины, которая выводится из организма с мочой. В норме в крови содержание мочевины составляет 2,5-8,6 ммоль/л.
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени.мочевина легко переносится кровью и выводится с мочой. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
Соли аммония(NH4)-образуется при диссоциации гидрата окиси аммония(NH4OH). Уровень ионов аммония находится в равновесии с небольшой концентрацией неионизированного аммиака.
Образование аммонийных солей идет путем нейтрализации гидратом окиси аммония различных кислот. Эта реакция имеет место в основном в почках:
NH3+HOHàNH4OH
NH4OH+HClàNH4Cl+HOH
Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
Биосинтез мочевины. Нарушение синтеза и выведения мочевины.
Немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта".
Локализован оринитиновый цикл в митохондриях печени и запускается ферментом карбомоилфосфатсинтетазой 1.
На первой стадии этого процесса из аммиака и углекислого газа синтезируется карбомоилфосфат:
АДФ NH2
АТФ /
СО2 + NH3 С=О
Карбомоилфосфат \
синтетаза 1 О-РО3Н2
карбомоилфосфат
Далее карбомоильная группа с помощью фермента орнитин-карбомоилтрансферазы переносится на орнитин образуется цитруллин,
• NH2 Н3РО4 NH2
• NH2 / /
• | + С=О С=О
• СН2 \ транскарбомоилаза \
• | О-РО3Н2 NH
• (СН2)2 |
• | СН2
• СН-NH2 |
• | (СН2)2
• COOH |
• орнитин СН-NH2
• |
• COOH
• Цитруллин
Под воздействием аргининосукцинат-лиазы аргининосукцинат разрушается на аргинин и фумарат
NH2 СООН АМФ + Н3РО4 NH СООН
/ | // | NH
С=О + СН2 АТФ С- NH-CН //
\ | \ | С-NH2
NH СН-NH2 синтетаза NH СН2 \ СООН
| | | | NH + |
СН2 COOH СН2 СООН лиаза | СН
| аспартат | СН2 ||
(СН2)2 (СН2)2 | СН
| | (СН2)2 |
СН-NH2 СН-NH2 | СООН
| | СН-NH2 Фумарат
COOH COOH |
Цитруллин Аргининосукцинат COOH
Аргинин
Далее аргинин гидролизуется аргиназой с образованием орнитина и мочевины.
NH
// NH2
С-NH2 |
\ NH2 СН2
NH / |
| + НОН С=О + (СН2)2
СН2 \ |
| аргиназа NH2 СН-NH2
(СН2)2 мочевина |
| COOH
СН-NH2 орнитин
|
COOH
аргинин
Орнитин вновь включается в процесс, реагируя с карбомоилфосфатом с образованием цитирулина и далее цикл синтеза мочевины повторяется.
Орнитиновый цикл до стадии образования цитируллина происходит в митохондриях, а последующие реакции идут в цитозоле.
При циррозе печени мощность орнитинового цикла снижена. В связи с этим и уровень мочевины в крови снижается и повышается уровень аммиака, т.е. наблюдается гипераммониемия. Нарушение синтеза мочевины и гипераммониемия возможна и по причине отсутствия соответствующих ферментов синтеза мочевины вследствие наследственного дефекта в геноме.
Специфические пути обмена аминокислот
Вовлечение в общие пути катаболизма без азотистых остатков аминокислот происходит, в конечном счете, через образование следующих метаболитов:
- -через пируват (аланин, цистеин, глицин, серин, треонин),
- -через ацетоацетил-КоА и ацетил-КоА (фенилаланин, тирозин, лейцин, лизин, триптофан),
- - через альфа-кетоглутарат (глутамат, аргинин, гистидин, пролин),
- - через сукцинил-КоА (изолейцин, метионин, валин),
- - через фумарат (тирозин, фенилаланин),
- - через щавелево-уксусную кислоту (аспартат).
Особенности обмена серосодержащих и ароматических аминокислот.
Метионин является незаменимой серусодержащей аминокислотой. Основная функция этой аминокислоты состоит в том, что она является донатором метильной группы, используемой для реакций метилирования.
В реакциях трансметилирования метионин находится ввиде S-аденозилметионина, образующимся из метионина и АТФ под воздействием метионин-аденозилтрансферазы
+S-СН2-СН2-СН- СООН H4P2O7 + Н3РО4
| | + АТФ
CН3 NН2
метионинаденозилтрансфераза
метионин
S-аденозил-метионин
S-аденозилметионин
• участвует в реакциях синтеза адреналина из норадреналина,
• В синтезе холина из коламина,
• в синтезе креатина из аминокислот глицина и аргинина,
• в метилировании оснований нуклеотидов нуклеиновых кислот,
• в синтезе мелатонина из N-ацетил-серотонина,
• участвует в обезвреживании лекарственных веществ и чужеродных соединений
S-аденозилгомоцистеин
Образующийся в реакциях трансметилирования из S-аденозил-метионина S-аденозилгомоцистеин, подвергается гидролитическому разрушению с образование аденозина и гомоцистеина:
СН2-SH
|
Н2О СН2
S-аденозилгомоцистеин аденозин + |
СН-NН2
|
СООН
гомоцистеин
Гомоцистеин может регенерировать в метионин в присутствии метил-ТГФК, либо используется для синтеза цистеина.
SН НO-СН2 Н2О S --- СН2 НО-СН2 СН2-SН
| | | | | |
СН2 СН-NН2 СН2 СН-NН2 + НОН СН2 + СН-NН2
| + | синтетаза | | гидролаза | |
СН2 СООН СН2 СООН СН-NН2 СООН
| серин | | цистеин
СН-NН2 СН-NН2 СООН
| | гомосерин
СООН СООН
гомоцистеин цистатионин
Цистеин является заменимой аминокислотой
• Из цистеина синтезируется глутатион, цистин и таурин. Образование таурина происходит в результате окисления цистеина вначале в цистеинсульфиновую кислоту, с последующим декарбоксилированием ее в таурин:
НАДФ
СН2-SН СН2-SО2Н СН2-SО2-ОН
| О2 | О2 НАДФН2 | + СО2
СН-NН2 СН-NН2 СН2-NН2 + Н2О
| оксидаза | декарбоксилаза таурин
СООН СООН
цистеин цистеинсульфиновая
кислота
• Таурин является соединением, образующим парные комплексы с желчными кислотами, выполняет специфическую, пока неясную функцию в фоторецепторных клетках сетчатки и нейромедиаторную функцию в нейронах мозга.
• Таурин нормализует уровень холестерина, предупреждает токсичное действие гомоцистеина, защищает от повреждения сосудистую стенку и препятствует образованию кровяных тромбов.
• Разрушение и образование без азотистого остатка цистеина может происходить следующим образом:
• глутамат НАДФ
• СН2-SН СН2-SН СН3
• | a-кетоглутарат | НАДФН2 |
• СН-NН2 С=О С=О + Н2S
• | трансаминаза | транссульфураза |
• СООН СООН СООН
• цистеин сульфпирутат пируват
• Пируват вовлекается в общие пути катаболизма, а сероводород (H2S) окисляется до сульфатов (H2SO4) и используется для образования фосфоаденозинфосфосульфата (ФАФС), для построения хондроитинсульфатов и других мукополисахаридов.
Синтез креатина и его биологическая роль.
Синтез кретина начинается в почках, где под воздействием глицин-амидинотрансферазы из глицина и аргинина образуются орнитин и гликоциамин. Из почек кровотоком гликоциамин доставляется в печень доставляется а печень, где метилируется в кретин за счет метильной группы S-аденозилметионина. Кретин доставляется в мышцы, где под воздействием креатинфосфокиназы превращается в макроэргическое соедтнение креатинфосфат, которое используется для сохранения уровня АТФ необходимого для мышечного сокращения и расслабления. Креатин может подвергать не ферментативному разрушению с образованием кретинина - соединение подлежащее удалению из организма с мочой
NH2
NH2 NH2 /
| / C=NHNH2
CH2 + C=NH \ |
| \ NH (CH2)3
COOHNH | + |
глицин | амидинотрансфераза CH2 CH-NH2
(CH2)3 | |
| COOHCOOH
CH-NH2 гликоциаминорнитин
|
COOH
аргинин
NH2 NH2
/ /
C=NHC=NH
\ S-аденозилгомоцистеин \
NHN-СH3
| S-аденозилметионин |
CH2 метилтрансфераза CH2
| |
COOHCOOH
гликоциамин креатин
NH2 NH-О-РО3Н2
/ /
C=NH АДФ C=NH
\ \
N-СH3 АТФ N-СH3
| |
CH2 креатинфосфокиназа CH2
| |
COOH COOH
креатин креатинфосфат
NH
/
НОН C=NH
\
N-СH3
|
CH2
|
CO креатинин
Нарушения обмена отдельных аминокислот.
Гомоцистинурия является симптомом наследственной недостаточности названных ферментов или следствием недостатка витамина В6, фолиевой кислоты и витамина В12.
Внешние проявления наследственной недостаточности цистатионинсинтетазы и, как следствие гомоцистинурии, весьма сходны с синдромом Морфана: высокий рост, арахнодактилия, деформация скелета, подвывих хрусталика, возможны гиперкинезы, судорожные состояния, отставание психического развития.
Нарушение катаболизма тирозина имеет место при алкаптонурии - ферментопатии, связанной с дефектом оксидазы гомогентизиновой кислоты.
При этом заболевании имеет место накоплениегомогентизиновой кислоты, которая в присутствии кислорода полимеризуется с образованием черного пигмента - алкаптона.
Алкаптон откладывается в коже, окрашивая ее в темно желтый цвет (охроноз), в хрящах и сухожилиях, вызывая деформацию суставов.
Отсутствие гистидазы приводит к гистидинемии - наследственному заболеванию, которое проявляется отставанием психомоторного развития ребенка и по клинике напоминает фенилпировиноградную олигофрению, но в менее выраженной форме.
Характерны нарушение речи, моторная алалия, снижение слуха, гидроцефалия,
имеет место судорожная готовность, деформация скелета.
Важным признаком заболевания служит отсутствие метаболитов уроканинового пути катаболизма гистидина в биологических жидкостях организма.
Лечение гистидинемии основано на тех же принципах, которые применяются при фенилпировиноградной олигофрении:назначаются белковые гидролизаты, лишенные гистидина.
Нарушения обмена триптофана
Болезнь Гартнепа - генетически обусловленное нарушение всасывания триптофана в кишечнике и проксимальных отделах почечных канальцев. Для болезни характерен : пеллагроподобный дерматит, фотодерматоз, хореоформный гиперкинез, умственная отсталость.
Синдром Тада -связан с эндогенным дефицитом никотиновой кислоты и избытком образования индольных соединений и триптофанурией. В результате развивается глубокая умственная отсталость и нанизм.
Синдром Прайса - накапливается кинуренин,формилкинуренин и другие метаболиты. В результате развиваются симптомы склеродермии.
Наследственная ксануренурия (синдром Кнаппа-Комровера). Болезнь вызвана недостаточной активностью пиридоксальзависимой кинурениназы.
Наследственная ксануренурия (синдром Кнаппа-Комровера). При этом заболевании имеют место изменения интеллекта и нарушения психики:
склонность к истерическим реакциям, состояниям аффекта и немотивированным поступкам, фобиии, сомнабулизм, приступы психомоторного возбуждения и судороги,
аллергические проявления кожи (аллергические дерматозы): себорейный дерматит, различные экземы, фотодерматоз, экзема, нейродерматит, упорный стоматит, хейлит и глоссит, бронхиальная астма
Переваривание и всасывание продуктов переваривания нуклеопротеидов.
Нуклеазы панкреатического сока катализируют гидролиз 5`3`-фосфоэфирные связи.
Различают два типа нуклеаз: ДНК-азы и РНК-аза.
В результате гидролиза полинуклеотидных цепей нуклеиновых кислот образуются мононуклеотиды (АМФ, ГМФ, ЦМФ, УМФ, d-ТМФ, d-АМФ, d-ГМФ, d-ЦМФ).
Мононуклеотиды под воздействием 5`-нуклетидаз кишечника разрушаются на нуклеозиды и фосфорную кислоту:
АМФ Н2О аденозин + фосфорная кислота
5`-нуклетидаза
ЦМФ Н2О цитидин + фосфорная кислота
5`-нуклетидаза
Нуклеозиды в свою очередь разрушаются нуклеозидазами кишечного сока до азотистых оснований и пентозы (рибоза или дезоксирибоза):
d-тимидин Н2О тимин + дезоксирибоза
нуклеозидаза
В стенку кишечника всасываются нуклеозиды, азотистые основания, пентозы и фосфорная кислота. Током крови от кишечника продукты переваривания нуклеопротеидов аминнокислоты, нуклеозиды, азотистые основания, пентозы, фосфорная кислота достовляются к печени и затем к другим органам и тканям
Биосинтез пуриновых нуклеотидов, происхождение частей пуринового ядра, начальные стадий биосинтеза (до 5-фосфорибозиламина). Инозиновая кислота как предшественник АМФ и ГМФ.
Для биосинтеза пуриновых нуклеотидов необходимо наличие глутамина, глицина, аспаратата, углекислого газа, формил-ТГФК и метенил-ТГФК - соединений, из которых формируется пуриновое ядро.
Формирование пуринового ядра происходит на рибозо-5-фосфате, который активируется за счет АТФ превращаясь в 5-фосфорибозил-1-пирофосфат.
Затем под воздействием фермента амидинофосфо- рибозил трансферазы с использованием аминогруппы глутамина образуется 5-фосфорибозиламин.
Далее в последовательных реакциях синтеза к 5-фосфорибозиламину присоединяется остаток глицина, метенильный радикал т.д.
На заключительной стадии образуется инозинмонофосфат (ИМФ):
Синтез АМФ
Синтез ГМФ
Распад пуриновых нуклеотидов. Образование мочевой кислоты.
Распад пуриновых нуклеотидов в тканях может осуществляться путем гидролитического отщепления фосфатного, рибозного или фосфорибозного остатка.
Этим реакциям может предшествовать гидролитическое дезаминирование АМФ и ГМФ или аденозина и гуанозина.
При дезаминировании АМФ образуется инозинмонофосфат.
При дезаминировании аденозина - инозин.
Дальнейший гидролиз инозина приводит к образованию гипоксантина
Образование мочевой кислоты происходит в печени. В норме в крови уровень мочевой кислоты равен 0,16-0,57 ммоль/л. Выводится вместе с мочой. В крови мочев.к-та связана с белками крови и стабилизируется ими. При подагре соли мочевой к-ты откладываются в мелких суставах, вызывая их деформацию, боли и нарушение их функций.
Распад и биосинтез пиримидиновых нуклеотидов.
Катаболизм пиримидиновых нуклеотидов. Пиримидиновые нуклеотиды соответствующими клеточными ферментами, гидролитически разрушаются до нуклеозидов, фосфорной кислоты, затем до азотистых оснований и пентоз (рибоза или дезоксирибоза).
Далее идет специфический путь катаболизма пиримидиновых оснований.
Цитозин дезаминируется с образованием урацила и аммиака. Урацил восстанавливается до дигидроурацила.
Затем происходит гидролитическая дециклизация дигидроурацила и образуется бета-уридопропионат, который гидролизуется с образованием СО2, аммиака и бета-аланина
Биосинтез пиримидиновых нуклеотидов
В построении пиримидинового ядра пиримидиновых нуклеотидов используются амидная группа глутамина, углекислый газ и аспартат.
Синтез начинается с образования карбомоилфосфата катализируемый карбомоилфосфат синтетазой II.
Этот фермент локализован, в отличие от карбомоилфосфатсинтетазы I, в цитозоле всех клеток организма.
Карбомоилфосфат синтетаза I локализована в митохондриях печени и запускает процесс синтеза мочевины.
Далее, под воздействием карбамоилтрансферазы II с использованием аспартата синтезируется уреидосукцинат который в последующих реакциях превращается в оротовую кислоту (оротат):
Биосинтез пуриновых и пиримидиновых нуклеотидов.
Биосинтез пуриновых нуклеотидов
Для биосинтеза пуриновых нуклеотидов необходимо наличие глутамина, глицина, аспаратата, углекислого газа, формил-ТГФК и метенил-ТГФК - соединений, из которых формируется пуриновое ядро.
Из инозиновой к-ты (ИМФ) синтезируется АМФ и ГМФ.
Биосинтез пиримидиновых нуклеотидов
В построении пиримидинового ядра пиримидиновых нуклеотидов используются амидная группа глутамина, углекислый газ и аспартат.
Синтез начинается с образования карбомоилфосфата катализируемыйарбомоилфосфат синтетазой II.
Этот фермент локализован, в отличие от карбомоилфосфатсинтетазы I, в цитозоле всех клеток организма.
Карбомоилфосфат синтетаза I локализована в митохондриях печени и запускает процесс синтеза мочевины.
Далее, под воздействием карбамоилтрансферазы II с использованием аспартата синтезируется уреидосукцинат который в последующих реакциях превращается в оротовую кислоту (оротат):
Нарушения обмена нуклеотидов. Подагра, лечение подагры.
Образование конечного продукта обмена пуриновых нуклеотидов мочевой кислоты происходит в печени.В норме в крови уровень мочевой кислоты равен 0,16-0,57 ммоль/л. Выводится вместе с мочой. Небольшая гиперурекемия приводит к кристаллизации и отложению кристаллов солей мочевой кислоты (урат натрия) в соединительной ткани, в суставах, сухожилиях, хрящах, в коже и в почках. Гиперурекемия наблюдается при ИБС и зачастую приводит к подагре. При подагре соли мочевой к-ты откладываются в мелких суставах, вызывая их деформацию, воспаление, боли и нарушение функций. Отложение уратов в почечных лоханках приводит к образованию почечных камней. Почечнокаменная болезнь долвольно частое осложнение при подагре. Гиперурикемия яв-ся основной причиной подагры. При лечении предупреждении подагры используют аллопуринолом. Аллопуринол, как структурный аналог гипоксантина. Прием аллопуринола в дозах 0,2-0,8 г в сутки снижает содержание мочевой к-ты в крови до нормальных величин и повышает уровень гипоксантина и ксантина.
Известна наследственная форма нарушения синтеза пиримидиновых нуклеотидов – оротацидурия. При этом заболевании вследствии недостаточности ферментов, катализирующих образование и декарбоксилирование оротидоловой к-ты возникает недостаточность пиримидиновых нуклеотидов, необходимых для синтеза нуклеиновых к-т, а оротовая к-та, наоборот накапливается.
Вследствие недостатка УТФ - аллостерического ингибитора карбомоилфосфат синтетазы, еще больше усиливается синтез оротовой кислоты, которая выводится в больших количествах с мочой. При охлаждении мочи таких больных оротовая кислота образует осадки в виде игольчатых кристаллов. Недостаток пиримидиновых нуклеотидов приводит к необратимому отставанию физического и умственного развития.
Ксантинурия. Оротацидурия.
Оротацидурия.Известна наследственная форма нарушения синтеза пиримидиновых нуклеотидов – оротацидурия. При этом заболевании вследствии недостаточности ферментов, катализирующих образование и декарбоксилирование оротидоловой к-ты возникает недостаточность пиримидиновых нуклеотидов, необходимых для синтеза нуклеиновых к-т, а оротовая к-та, наоборот накапливается.
Вследствие недостатка УТФ - аллостерического ингибитора карбомоилфосфат синтетазы, еще больше усиливается синтез оротовой кислоты, которая выводится в больших количествах с мочой. При охлаждении мочи таких больных оротовая кислота образует осадки в виде игольчатых кристаллов. Для лечени этой болезни применяют уридин 0,5-1г в сутки это обеспечивает образование УМФ и др.пиримидиновых нуклеотидов в обход нарушенных реакций.
Оротацидурия возможна и при гипераммонийемии, когда нарушается функция ферментов орнитинового цикла и карбомоилфосфат используется не для синтеза мочевины, а для образования пиримидиновых нуклеотидов, в том числе и оротовой к-ты.
Ксантинурия-- наследственная болезнь, обусловленная недостаточностью фермента ксантиноксидазы и характеризующаяся нарушением пуринового обмена; проявляется рецидивирующей гематурией и болями в поясничной области, повышением содержания ксантина в плазме крови и моче.
Ксантин является непосредственным предшественником мочевой кислоты. Он образуется из некоторых пуринов, в то время как гипоксантин относится к промежуточным продуктам. Окисление гппоксантипа в ксантин, а последнего в мочевую кислоту опосредуется ксантиноксидазой, выявленной в печени и слизистой оболочке кишечника.
Ксантинурия встречается редко. Уровень мочевой кислоты в сыворотке больных (1 - 8 мг/л) обычными методами не выявляется. Низкий уровень гипоксантина отмечается как в крови, так и в моче. При потреблении продуктов, не содержащих пуринов, мочевая кислота прекращает экстретироваться. Ксантин даже менее растворим в моче, чем мочевая кислота; соответственно у некоторых больных с ксантинурией образуются мочевые камни, состоящие из чистого ксантина.
4. Понятие об азотистом балансе. Причины и последствия белкового голодания: в зрелом
и раннем детском возрасте. Квашиоркор.
Для оценки состояния обмена белков используется понятие азотистый баланс. Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.
Различают 3 вида азотистого баланса:
1. Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.
2. Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей.
3. Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
Квашиоркор — тяжелое расстройство питания у детей, обусловленное значительной белковой недостаточностью. Представляет особый вариант гипотрофии .К. наблюдается у детей до 5 лет, чаще возникает после прекращения грудного вскармливания. Белковая недостаточность может быть следствием количественного или качественного несоответствия питания возрасту ребенка, например преимущественного использования продуктов с низким содержанием белка (каши) или содержащих белки с низкой биологической ценностью.Причинами белковой недостаточности могут быть также врожденные нарушения обмена аминокислот, нарушения всасывания белка в кишечнике (например, при глютеновой болезни, энтеропатии экссудативной), повышенные потери белка с мочой при нефротическом синдроме, нарушение синтеза белка, например при хронических болезнях печени. В ряде случаев белковая недостаточностьразвивается при тяжелых инфекционных болезнях, кровотечениях,ожогах. Недостаточность белка, часто сочетающаяся с дефицитом энергии, витаминов и микроэлементов, приводит к нарушению развития ребенка, дистрофическим изменениям органов и тканей. Ведущим в патогенезе К. является недостаток в организме ребенка пластических веществ и ферментов, Особенно легко К. развивается у детей раннего возраста, т.к. для обеспечения интенсивных процессов роста и развития необходимо поддержание постоянного положительного азотистого баланса в организме (поступление белков должно превышать их расходование).
5.Диагностическое значение биохимического анализа желудочного сока.
Одним из показателей функциональной активности желудочного сока является кислотность, которая определяется титрованием желудочного сока 0,1М раствором NаОН и выражается в условиях базальной секреции тремя константами в единицах кислотности.
В норме кислотность желудочного сока равна:
общая кислотность - 40-60 ед. кислотности
свободная НCl - 20-40 ед. кислотности
связанная HCl - 10-12 ед. кислотности
За единицу кислотности принимается количество миллилитров 0,1М раствора NаОН, которые расходуется для нейтрализации 100 мл желудочного сока.
6.Гниение белков (аминокислот) в кишечнике. Обезвреживание продуктов гниения
аминокислот.
Дефицит протеолитических ферментов поджелудочной железы приводит к выделению не переваренных белков с калом. Не переваренные белки подвергаются разрушению микроорганизмами толстого кишечника. Этот процесс называется гниением белков в кишечнике . В результате гниения белковаминокислоты используются бактериями кишечника как энергетический материал, где разрушаются с образованием ядовитых соединений спиртов , альдегидов, аминов., фенола индола скатола сероводорода которые могут всасываться в кровь и если не будут обезврежены, могут оказать токсическое воздействие на организм.Образование ядовитых продуктов в бактериях толстого кишечника идет в результате реакций декарбоксилирования и дезаминирования аминокислот. При декарбоксилировании орнитина образуется путресцин, при декарбоксилировании лизина - кадаверин. Оба этих амина (путресцин и кадаверин) являются трупными ядами.
СН2-СН2-СН2-СН-СООН СН2-СН2-СН2-СН2
| | | | + СО2
NH2 NH2 NH2 NH2
орнитин путресцин
СН2-СН2- СН2--СН2 -СН-СООН СН2-СН2-СН2-СН2-СН2
| | | | + СО2
NH2 NH2 NH2 NH2
лизин кадаверин
При разрушении тирозина образуется тирамин, крезол и фенол:
СН2-СН-СООН СН2-СН2 СН3
| | | | |
//\ NH2 //\ NH2 //\ //\
| || ® | || ® | || ® | ||
\\/ \\/ \\/ \\/
| | | |
ОН ОН ОН ОН
тирозин тирамин крезол фенол
При разрушении триптофана образуются триптамин, индолилуксусная кислота, скатол, индол и индоксил:
//\ __ _CН2-СН-СООН //\ __ _CН2-СН2 //\ __ _CН2-СООН
| || || | ® | || || | ® | || ||
\\/ \ / NH2 \\/ \ / NH2 \\/ \ /
NH NH NH
триптофан триптамин индолилуксусная кислота
//\ __ _CН3 //\ __ //\ __ _ОН
® | || || ® | || || ® | || ||
\\/ \ / \\/ \ / \\/ \ /
NH NH NH
скатол индол индоксил
Обезвреживание этих ядов происходит в печени путем образования коньюгатов с серной или глюкуроновой кислотой. Серная кислота, как коньюгат, находится в гепатоцитах активном виде в составе фосфоаденозинфосфосульфата (ФАФС). Глюкуроновая кислота находится в составе УДФ-глюкуроновой кислоты.
7.Механизмы внутритканевого катаболизма аминокислот.
80% аминокислот, которые поступают в организм из желудочно-кишечного тракта, используются для синтеза белков. Остальные 20% вступают в метаболические процессы. Все эти процессы можно разделить на 2 группы:
1. Общие пути катаболизма аминокислот (для всех аминокислот они одинаковы). В них принимает участие общая часть молекулы аминокислоты.
2. Специфические пути метаболизма для каждой отдельной аминокислоты (разные для разных аминокислот) - участвуют радикалы аминокислот. Это - особенности обмена отдельных аминокислот.
ОБЩИЕ ПУТИ КАТАБОЛИЗМА АМИНОКИСЛОТ
1. Декарбоксилирование
2. Дезаминирование
3. Трансаминирование (переаминирование)
Трансаминирование или переаминироаёвание аминокислот катализируется ферментами из класса трансфераз-трансаминазами. Коферментом этих ферментов является фосфопиридоксаль производное витамина В6. при этой реакции аминогруппа аминокислоты обменивается на альфа-кетогруппу одной из трех альфа кето кислот: пировиноградной ,щавелевоуксусной, альфа-кетоглутаровой .
Дезаминирование аминокислот происходит путем отщепления аминогруппы с образованием аммиака и без азотистого отсатка, который может быть представлен в виде кислоты, гидоэроксикислоты, ненасыщенной кислоты или кетокислоты. Различают 4 варианта дезаминирования : восстановительное, гидролитичечое, внутримолекулярное и окислительное.
Дкарбоксилирование аминокислот, как одна из реакций катаболизма , катализируется декарбоксилазами, кофермнтом которых является призводное В6-фосфопиридоксаль (ФП-СН=О). Продуктами декарбоксилирования аминокислот являются углекислый газ и амины, обладающие высокой биологической активностью, поэтому их называют биогенными аминами.
8.Трансаминирование, специфичность трансаминаз. Коферментная роль витамина В6.
Диагностическое значение определения трансаминаз в сыворотке крови.
Трансаминирование или переаминироаёвание аминокислот катализируется ферментами из класса трансфераз- трансаминазами. Коферментом этих ферментов является фосфопиридоксаль производное витамина В6. при этой реакции аминогруппа аминокислоты обменивается на альфа-кетогруппу одной из трех альфа кето кислот: пировиноградной , щавелевоуксусной, альфа-кетоглутаровой .
СООН СООН
| |
R СН2 ФП-СН=О R СН2
| + | | + |
СН-NH2 СН2 трансаминаза С=O СН2
| | | |
COOH С=О COOH СH-NH2
| |
СООН СООН
альфа-кетоглутарат глутамат
В клетках печени функционирует органо-специфичная глутамико-аланиновая трансаминаза (ГАлТ), а в кардиомиоцитах - глутамико-аспаригиеёновая трансаминаза(ГАсТ) . Определение активности этих ферментов может быть использован как диагностический тест, свидетельствующий о нарушении целостности клеток сооответствующего органа. Так повышение активности в сыворотке крови фермента АсТ наблюдается при инфаркте миокарда, повышение активности фермента АлТ при гепатитах ( болезнь Боткина)
СООН СООН
| |
СН3 СН2 ФП-СН=О СН3 СН2
| + | | + |
СН-NH2 СН2 ГАлТ С=O СН2
| | | |
COOH С=О COOH СH-NH2
аланин | пируват |
СООН СООН
альфа-кетоглутарат глутамат
СООН СООН СООН СООН
| | | |
СН2 СН2 ФП-СН=О СН2 СН2
| + | | + |
СН-NH2 СН2 ГАсТ С=O СН2
| | | |
COOH С=О COOH СH-NH2
аспартат | ЩУК |
СООН СООН
альфа-кетоглутарат глутамат
9.Различные пути дезаминирования аминокислот. Окислительное дезаминирование аминокислот.
Дезаминирование аминокислот происходит путем отщепления аминогруппы с образованием аммиака и без азотистого отсатка, который может быть представлен в виде кислоты, гидоэроксикислоты, ненасыщенной кислоты или кетокислоты. Различают 4 варианта дезаминирования : восстановительное, гидролитичечое, внутримолекулярное и окислительное. Для организма чедовека наиболее активным является окислтёительное дезаминирование аминокислот. Окислительное дезаминирование катализируется оксидазами аминокислот, локализованных в пероксисомах клеток. Оксидазы L-аминокислот используют в качестве кофермента ФМН, а оксидазы D-аминокислот - ФАД. Катализируемая ими реакция идет следующим образом:
ФМНН2 (ФАДН2) ®… О2® 2НО-ОН ® 1/2О2 + НОН
R R R
| ФМН (ФАД) | + НОН |
СН-NН2 СН=NН С=О + NH3
| | |
СООН СООН СООН
аминокислота иминокислота кетокислота
Окислительное дезаминирование глутамата идет следующим образом:
НАДН2® ...1/2О2 ® 3АТФ + НОН
СООН СООН СООН
| НАД | + НОН |
(СН2)2 (СН2)2 (СН2)2 + NH3
| ГДГ | |
СН-NН2 СН=NН С=О
| | |
СООН СООН СООН
глутамат альфа-кетоглутарат
10.Непрямое дезаминирование аминокислот. Биологическое значение дезаминирования аминокислот.
Непрямое дезаминирование аминокислот или трансдезаминирование, происходит в два этапа.
На первом этапе аминокислоты вступают в реакцию трансаминирования с альфа-кетоглутаратом, который превращается в глутамат.На втором этапе происходит окислительное дезаминирование глутамата.
СООН СООН
| ФП-СН=О |
R-CН-NH2 трансаминаза R-C=O
аминокислота кетокислота
СООН СООН
| |
СН2 СН2
| НАДН2 |
СН2 СН2
| НАД | + NH3
СН-NH2 С=О
| (глутаматдегидрогеназа) |
СООН СООН
глутамат альфа-кетоглутарат
Другой путь непрямого дезаминирования аминокислот включает процесс переноса их аминогруппы в ркёеакциии трансаминирования с оксалоацететом (ЩУК) на аспартат при участии аспартат аминотрансферазы( АсТ):
Аминокислота + ЩУК кетокислота + аспартат
Затем передает маиногруппу на инозинмонофосфат (ИМФ) - образуется аденозинмонофосфат(АМФ) и фумарат.Далее АМФ под воздействием АМФ -дезаминазы гидролитически дезаминизируется - образуется ИМФ и аммиак.ИМФ вновь включается в цикл непрямого дезаминирования аминокислот .Фумарат в цикле Кребса превращается в малат и далее в оксалоацет, далее цикл повторяется. Этот сложный пуить дезаминирования аминокислот особенно активнопротекает в мышечной и нервной ткани где ГДГ не особенно активна и высока активнось АсТ и АМФ-дезаминазы.
11.Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, гамма-амино-масляная кислота, катехоламины, образование и биологические функции.
Дкарбоксилирование аминокислот, как одна из реакций катаболизма , катализируется декарбоксилазами, кофермнтом которых является призводное В6-фосфопиридоксаль (ФП-СН=О). Продуктами декарбоксилирования аминокислот являются углекислый газ и амины, обладающие высокой биологической активностью, поэтому их называют биогенными аминами. Некоторые биогенные амины исполняют роль медиаторов нервной системы и оказывают регуляторное действие на метоболические процессы и функции клеток и органов.
Придекарбоксилировании гистидина образуется гистамин- медиатор воспаления.
N -CН2-СН-СООН ФП-СН=О N _CН2-СН2
|| || | СО2 + || || |
\NН/ NH2 декарбоксилаза \NН/ NH2
гистидин гистамин
При декарбоксилировании 5-гидрокстриптофана образуется биогенный амин серотонин.
ОН НО
\ //\ ___ _СН2-СН-СООН ФП-СН=О \ //\ ___ _СН2-СН2
| || || | CO2 + | || || |
\\/ \NН/ NН2 декарбоксилаза \\/ \NН/ NН2
5-гидрокситриптофан серотонин
Серотонинисполняет роль местного гормона. В сером веществе мозга, в гипоталамусе серотонин исполняет роль медиатора. Считается , что серотонин необходим для сна. Является биологическим предшественником гормона эпифиза мелотонина.
НО СН3-О
\ //\ ___ _СН2-СН2 \ //\ ___ __СН2-СН2 СН3
| || || | | || || | |
\\/ \NН/ NН2 \\/ \NН/ NН--С=О
серотонин мелатонин
При декарбоксилировании глутамат образуется биогенный амин- гамма-амино- масляная кислота (ГАМК) являетсямедиатором тормозных синапсов нервной системы, содержится в гипоталамусе
СООН СООН
| |
СН2 CO2 СН2
| |
СН2 декарбоксилаза СН2
| |
СН-NH2 СН2-NH2
|
СООН ГАМК
глутамат
Биогенные амины , образующиеся при декарбоксилировании тирозина диоксифенилаланина(ДОФА) , выполняют медиаторные функциии называются катехоламины. к ним относятся дофамин , адреналин , норадреналин
ОН ОН ОН
| НО | СО2 НО |
/ \\ ( О ) \/ \\ \/ \\ вит С Сu (О)
|| | || | || |
\ // тирозиназа \ // декарбоксилаза \ // бета-гидроксилаза
| | | дофамина
CН2-СН-CООН СН2-СН-CООН CН2-СН2
| | |
NH2 NH2 NH2
тирозин ДОФА дофамин
ОН S-аденодигомоцистеин ОН
НО | НО |
\/ \\ S-аденозилметионин \/ \\
|| | || |
\ // N-метилтрансфераза \ //
| |
CН -СН2 CН -СН2
| | | |
ОН NH2 ОН NH-СН3
норадреналин адреналин
Дофамин образуется в синапсах цнс, в сетчатке, симпатичечких ганглиях, где играет роль медиатора. Норадреналин и адреналин синтезируются в хромаффинных клетках мозгового вещества надпочечников и выполняют гормональную функцию. Синтезируются в адренергических синапсах головного мозга и в окончаниях симп. нервов вегет. нерв системы, исполняя ф-ии медиаторов.
12.Окисление биогенных аминов (моноаминооксидазы), ингибиторы МАО.
Обезвреживание биогенныз аминлв осуществляется несколькими путями: путем окислительного дезаминирования, путем метилирования, путем реакций коньюгации. основной путь обезвреживания биогенных аминов это окислительное дезаминирование , катализируемое амоноксидазами:
H
( О ) |
R-СН2-NH2 R-С=О + NН3
амин аминоксидазаальдегид аммиак
Различают 2 типа аминоксидаз- моноаминоксидазы (МАО) и диаминоксидазы (ДАО). Коферментом МАО является ФАД , кофермнтом ДАО - фосфопиридоксаль. МАО инактивирует первичные . вторичные и третичные амины , в т.ч. и катехоламины.ДАО - инактивирует гистамин, путресцин, кадаверин. Второй путь обезвреживания катехоламинов - О-метилирование под воздействием фермента катехол-О метилтрансферазы . Донатором метильных групп в этой реакции служит S-аденозилметионин. Продукты дезаминирования биогенных аминов- альдегиды окисляются с помощью альдегид дегидрогеназы до органических кислот.В клинической практике зачастую используются препараты , изменяющие метаболиз биогенных аминов. В частности для лечения депрессивных состояний , шизофрении, гипертонической болезни используются ингибиторы МАО -ипразид, ипраниазид, гармин
13.Роль гистамина в развитии воспаления и аллергических реакций. Антигистаминные препараты.
Гистамин-биогенный амин который образуется при декарбоксилировании гистидина. Почти все органы и ткани содержат гистамин.
N -CН2-СН-СООН ФП-СН=О N _CН2-СН2
|| || | СО2 + || || |
\NН/ NH2 декарбоксилаза \NН/ NH2
гистидин гистамин
Особенно много его в ткани легких и коже. Имется гистамин в спинном мозге и в подкорковых образованиях головного мозга. Гистамин образуется в слизистой желудка, где влияет на секрецию пепсина и соляной кислоты. Гистамин образуется и депонируется в тучных клетках соединительной ткани в виде белково-гепаринового комплекса. В крови гистамин связан с гранулами базофилов и эозинофилов.
Освобождение гистамина из клеток в межклеточную среду может происходить при разнообразных воздействиях- ожог,охлаждение, электрическое и химическое раздражениеи др.
Анафилактическая и аллергическая реакции организма сопровождаются высвобождением гистамина из тучных клеток. Местное высвобождение гистамина вызывает локальное повышение температуры, отек , боль, покраснение т.е. признаки воспаления.
При повышении уровня гистамина в крови наблюдаются следующие явления:
-расширение артериол и капилляров( в том числе и в коже), в результате снижается кровяное давление
-повышается проницаемость капилляров, в результате жидкость из крови выходит в межклеточнуюсреду, давление еще более снижается
- выходит жидкости из крови в головном мозге приводит к повышению внутричерепного давления, гипергидратации нервной ткани и к головной боли
-гистамин вызывает сокращение гладкой мускулатуры легких , что проявляется как приступы удушья
Для предотвращения эффектов гистаминав клинической практике часто используются препараты-димедрол, пипольфен, супрастин,диазолин и др.
14.Нарушения обмена биогенных аминов при психических заболеваниях.
| <== предыдущая страница | | | следующая страница ==> |
| Вопросник 56-5 «Языковое законодательство РФ» | | | Регуляция обмена веществ. Гормоны |
Дата добавления: 2014-09-10; просмотров: 1488; Нарушение авторских прав

Мы поможем в написании ваших работ!