
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические свойства S-элементов, их применение в медицине»
Упражнение 1. Укажите биологическую роль внутриклеточного магния и кальция.
Ответ: Клетка не может существовать без катионов Mg2+ и Са2+ , которые играют чрезвычайно важную роль в регуляции ряда жизненно важных процессов в организме. Mg2+ - внутриклеточный ион, который находится в цитоплазме преимущественно в связанном состоянии с АТФ, фосфолипидами, нуклеиновыми кислотами. Mg2+ - эссенциальный элемент, участвующий в активации практически всех ферментов и метаболических процессов, как антагонист Са2+ необходим для передачи нервных импульсов и мышечных сокращений. Ионы Са2+ находятся в основном вне клетки, в цитоплазме его концентрация меньше в 10000 раз. Градиент комнцентрации ионов с разных сторон мембраны клеток обеспечивает возникновение мембранного потенциала (60-80 мВ). Внутриклеточный Ca2+ участвует в передаче регуляторных сигналов (вместе с ацетилхолином). Необходимо обеспечение гомеостаза внутриклеточного кальция, поскольку повышение его уровня приводит к гибели клеток. Для поддержания низкой концентрации используют препараты, называемые антагонистамии кальция, которые применяют для лечения гипертонии, профилактики гипертрофии сердечной мышцы, развития сердечной недостаточности, нарушений ритма, защиты почек. К числу антагонистов кальция относят, в частности производные 1,4-дигидропиридина (нифедипин), которые специфически связываются с рецептором и блокирует кальциевые каналы, ограничивая поступление катионов Ca2+ внутрь клетки.
Соединения, способные химически связывать Ca2+ , чрезвычайно токсичны, например 2,2/-дипиридил. Ниже приведена реакция катионов Ca2+ с (2,2/-дипиридилом).
Задача 1. Разбавленные растворы KMnO4, пероксида водорода H2O2используются в медицинекак окислители исключительно наружно, поскольку при введении внутрь вызывают ожоги слизистых оболочек. Растворы KMnO4, окрашивают кожу и используемую посуду в коричневый цвет. При взаимодействии KMnO4, с H2O2в кислой среде окраска исчезает, при этом выделяется атомарный кислород, который, как и указанные растворы, обладает бактерицидным действием. Атомарный кислород образует молекулу O2. Рассчитайте объём О2 (н.у.), который выделится при реакции 1,58 г KMnO4 с избытком раствора пероксида водорода и уксусной кислоты.
Решение:
2 KMnO4 +5 H2O2 +6 CH3COOH = 2 Mn(CH3COO)2 +5 O2↑ +2 CH3COOK + 8 H2O
Ионы Mn2+ менее токсичны по сравнению с ионами MnO4-.
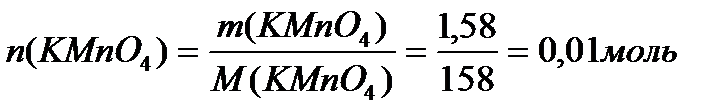
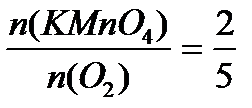
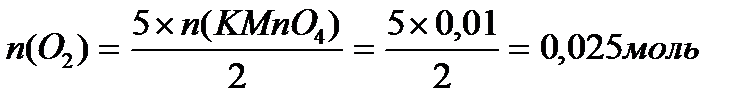
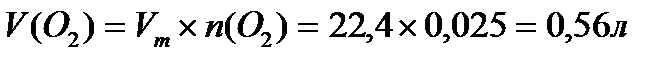
Ответ: V(O2) = 0,56 л
Упражнения и задачи для самостоятельной работы
Упражнение 1. Бромид калия используется в медицине как успокаивающее средство. Опишите аналитические эффекты, которые будут наблюдаться при добавлении к этому веществу:
a) нитрата серебра
b) перманганата калия в кислой среде
Напишите уравнения химических реакций.
Упражнение 2. Укажите применение в медицине: Na2SO4∙´ 10H2O, растворов NaCl, NaHCO3, Na2B4O7, KBr, KCl, CaCl2, суспензий MgO, MgSO4×7H2O, CaSO4, BaSO4.
Упражнение 3. Запишите уравнения гидролиза карбоната и гидрокарбоната натрия, укажите рН раствора. Почему раствор гидрокарбоната натрия используется для полоскания горла при воспалении?
Упражнение 4. Уравняйте следующие окислительно-восстановительные реакции:
NaI + H2SO4 ® Na2SO4 + I2 +H2S +H2O
NaClO3 +NaCl + H2SO4 ® NaHSO4 + Cl2 + H2O
K2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O
Упражнение 5. В чём заключаются функции кальция в организме? Почему магний считается эссенциальным элементом.
Задача 1. В хирургической практике применяется раствор пероксида водорода с массовой долей 3%. Сколько надо миллилитров раствора пероксида водорода с массовой долей 26% (r =1,1г/мл), для приготовления 500 мл 3% раствора (r = 1,05 г/мл)?
Ответ: 55 мл
Задача 2. При некоторых заболеваниях в организм вводят раствор хлорида натрия с массовой долей 0,9%, называемый физиологическим. Вычислите сколько воды и соли нужно для приготовления 1 литра физиологического раствора, плотность которого 1,005 г/мл.
Ответ: 9,04г NaCl и 996г воды
Задача 3. Для нейтрализации щелочи, попавшей на кожу, применяется раствор борной кислоты с массовой долей 2%. Сколько насыщенного раствора борной кислоты, массовой долей 4,7% , понадобиться для приготовления 0,5л раствора с массовой долей 2%? Плотность принять равной 1 г/мл.
Ответ:212,8 мл
Задача 4. В медицинской практике для промывания ран и полоскания горла применяется 0,5% раствор перманганата калия. Сколько граммов раствора, полученного растворением 6,4г этой соли в 100г воды и чистой воды необходимо для приготовления 1л 0,5% раствора? Плотность можно принять равной 1г/мл.
Ответ: 83,3г и 916,7мл Н2О
Задача 5. Перманганатом калия можно лечить змеиные укусы при отсутствии специальной сыворотки. Ддя этого в место укуса вводят шприцем 0,5-1,0 мл 1%-ного раствора KMnO4. Рассчитайте массу перманганата калия и объём воды, необходимый для приготовления 75 мл такого раствора, имеющего плотность 1,006 г/мл.
Ответ:m(KMnO4)=0.754г, V(H2O)=75мл
Тестовые вопросы
1. С какими катионами молекулы АТФ (аденозинтрифосфата) и АДФ (аденозиндифосфата) образуют комплексы по фосфорил-группировке?
1)Рb 2) Мg 3) Zn 4) К
2. Избыток ионов натрия способствует_____.
1) алкалозу 2) задержке жидкости;
3) растворению костной ткани; 4) ацидозу
3. Действие, какого гормона регулирует метаболизм кальция?
1) альбумина 2) кальцитонина 3) каталазы 4) миоглобина
4. Какой раствор NaCl можно использовать в качестве гипертонического?
1) 0,4 % 2) 0,9% 3) 5% 4) 0,5%
5. Раствор какой соли используют для обработки гнойных ран?
1) 5% раствор KCl 3) 10% раствор NaCl
2) 10% раствор CaCl2 4) 0,9% раствор NaCl
6. Ионы Ва2+ токсичны для организма за исключением соли, которую используют как рентгеноконтрастное вещество. Укажите эту соль.
1) BaCl2 2) BaSO4 3) Ba(NO3)2 4) BaSO3
7. Какой препарат применяют в качестве слабительного, желчегонного и спазмолитического средства?
1) MgO 2) MgCO3 3) MgSO4 4)) MgCl2
8) Укажите формулу соединения марганца, которое применяется в медицине для наружных целей в качестве окислителя.
1) MnO2 2) KMnO4 3) K2MnO4 4) MnCl2
9. Работа калий-натриевого насоса сопряжена с гидролизом соединений___.
1) Na2HPO4; 2) АТФ; 3) АДФ; 4) креатинфосфата.
10. Какой из приведенных элементов является наиболее активным металлом?
1) Мn 3) Сu 2) Fе 4) Nа
11. Металлические свойства химических элементов в ряду Мg, Nа, К_____.
1) возрастают 3) вначале возрастают, затем уменьшаются
2) уменьшаются 4) вначале ослабевают, затем усиливаются
12. В каком ряду указаны элементы, относящиеся к s-, р- и d-семействам?
1) Н, Нe, Li 2) Ве, С, О 3) Н, С, Аl 4) Мg, Р, Сu
13. Йодид калия имеет ____кристаллическую решетку.
1) молекулярную 3) ионную
2) атомную 4) металлическую
14. Кристаллическая решетка хлорида кальция_______.
1) ионная 3) металлическая
2) молекулярная 4) атомная
15. Какой из приведенных элементов является наиболее активным металлом?
1) Мn 2) Сu 3) Fе 4) Nа
16. Определите, какими свойствами обладает оксид кальция, исходя из реакции
CaO + H2O = Ca(OH)2
1) кислотными 3) амфотерным
2) основными 4) несолеобразующими
17. Какие из приведенных ниже солей являются средними?
1) CaOHCl 2) KHCO3 3) Na2HPO 4 4) CaCl2 5) KHS
18. Укажите электронную формулу внешнего уровня для наиболее активного металла.
1) 2s1 2) 3s2 3) 3s1 4) 3s23р3
19. Со щелочами взаимодействуют оксиды____.
1) серы (IV) 2) железа (II) 3) азота (II) 4) хрома (II)
20. Какие из приведенных пар оксидов будут взаимодействовать между собой ?
1) Na2O и N2O5 2) Na2О и K2O 3) SiO2 и SO3 4) NO2 и SO2 5) P2O5 и SiO2
21. Формулы только основных солей указаны в ряду________.
1) KHCO3, Na2Cr2O7, (CuOH)2SO4 3) CuCl2, NaHSO3, (AlOH)Cl2
2) Ca(HCO3)2, ZnS, (FeOH)Cl 4) (FeOH)NO3, (CuOH)2CO3, MgOHCl
22. Общее число электронов в катионе калия равно___.
1) 39 2) 20 3) 19 4) 18
23. Средняя соль образуется при взаимодействии _____.
1) 1 моль Ba(OH)2 и 1 моль HCl 3) 1 моль Cu(OH)2 и 2 моль H2SO4
2) 2 моль Mg(OH)2 и 1 моль HCl 4) 1 моль Ca(OH)2 и 2 моль HCl
24. Между собой взаимодействуют соединения______,
1) Na2O, N2O5 2) CO2, SO3 3) K2O, CaO 4) BaO, CrO3
25. В ряду оксидов Na2O → MgO → Al2O3 происходит переход от___________.
1) основного оксида к амфотерному 3) основного оксида к кислотному
2) кислотного оксида к основному 4) амфотерного оксида к кислотному
26. Какие из приведенных оксидов взаимодействуют с гидроксидом калия КОН?
1) Na2O 2) CaO 3) SO2 4) CuO 5) K2O
27. Какие из приведенных ниже оксидов проявляют основные свойства?
1) SO3 2) ZnO 3) P2 O5 4) Na2O 5) SiO2
28. Ионный характер связи наиболее выражен в соединении_______,
1) CCI4 2) CaBr2 3) SiO2 4) NH3
29. Ионными соединениями являются ___________.
1) H2Se 2) CaF2 3) LiCl 4) SiF4
30. В молекуле BeCI2 угол между связями равен____________.
1) 900 2) 1800 3) 1200 4) 1090
| <== предыдущая страница | | | следующая страница ==> |
| Задача 9 | | | Химические свойства р-элементов и их соединений |
Дата добавления: 2014-09-10; просмотров: 1014; Нарушение авторских прав

Мы поможем в написании ваших работ!