
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОПРЕДЕЛЕНИЕ КОСВЕННЫХ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ПРИРОДНЫХ И СТОЧНЫХ ВОД
9.1. Кондуктометрический анализ
Кондуктометрический анализ применяется для измерения концентрации растворов электролитов по их удельной электропроводности. Электропроводность - это величина, обратная электрическому сопротивлению проводника. Она зависит от концентрации растворенных в воде веществ и температуры. Между удельной электропроводностью и концентрацией растворенных веществ зависимость близка линейной. Поэтому используя измерение электропроводности, можно определить концентрацию однокомпонентного раствора, а для воды - ее солесодержание. Приборы, с помощью которых кондуктометрическим методом определяют содержание солей в воде, называют кондуктометрическими концентратомерами, иногда солемерами.
Для измерения электропроводности используются электролитические ячейки, состоящие из двух электродов, установленных на расстоянии L друг от друга в сосуде с контролируемой жидкостью. Если площадь электродов S, а удельная электрическая проводимость жидкости X, то сопротивление электролитической ячейки равно:
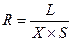 .
.
Для каждой конструкции ячейки:
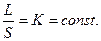
Следовательно, 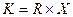 .
.
Величина К называется постоянной ячейки.
Измеритель электропроводности - кондуктометр обычно состоит из датчика с электродной системой, преобразователя и вторичного прибора. Для автоматического определения содержания солей наиболее удобным является солемер конструкции ЦКТИ. Его датчик (рис.24) состоит из двух цилиндров 1 и 2, которые являются электродами. Между ними протекает контролируемая жидкость. Во внутреннем цилиндре 2 помещен патрон 3 электрического термометра сопротивления. Цилиндры изолированы друг от друга эбонитовым дном 4 и такой же крышкой 5, через которую выпущены провода цилиндров и термометров.
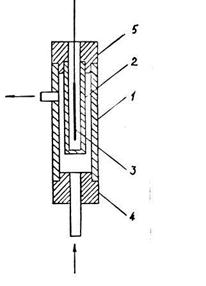
Рис.24 . Датчик автоматического солемера
Содержание солей определяется в зависимости от электропроводности и температуры, а измерение электропроводности практически сводится к измерению сопротивления слоя проточной веды между цилиндрами 1 и 2.
9.2. Контроль рН
Водородный показатель — это мера активности ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженный в молях на литр:
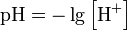
В чистой воде при 25 °C концентрации ионов водорода [H+] и гидроксид-ионов [OH-] одинаковы и составляют 10−7 моль/л. Это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH-] и составляет 10−14 моль²/л².
Величина рН является наиболее универсальным параметром регулирования процессов химической очистки природных и сточных вод. Она характеризует степень кислотности и щелочности воды, определяет скорость и направление многих химических реакций. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метилоранж и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы. Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Для автоматического измерения рН удобнее использовать электрометрические методы. Разность потенциалов между электроламп является величиной, характеризующей концентрацию ионов в растворе. Обычно один электрод является сравнительным, а второй - измерительным. На рис.25 показана схема измерения величины рН. В раствор опущен стеклянный электрод 1 и каломельный электрод 7. Разность потенциалов между электродами пропорциональна величине рН и измеряется потенциометром 4. Стеклянный электрод 1 представляет собой трубку с толстостенным полым шариком из специального известково-натриевого или литиевого электродного стекла. Внутренняя полость шарика заполнена раствором 3 с постоянным и известным значением рН. В этот раствор погружен вспомогательный хлор-серебряный контактный электрод 2, который служит для снятия потенциала с внутренней поверхности шарика. Каломельный электрод 7 представляет собой корпус, выполненный из диэлектрика, в который залита ртуть 5. Для контакта с ртутью в дно сосуда впаяна платиновая проволока. Над ртутью помещается слой малорастворимой каломельной пасты. Остальная часть сосуда заполнена насыщенным раствором хлористого калия 8. Таким образом, электрический контакт каломельного электрода с исследуемым раствором осуществляется через раствор хлористого калия. Постоянный потенциал в каломельном растворе образуется на границе ртуть-каломель. В месте соприкосновения контролируемого раствора с электрическим контактом устанавливается полупроницаемая перегородка 9,через которую под небольшим давлением просачивается хлористый кадий.
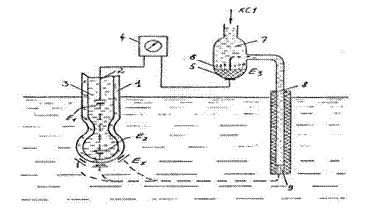
Рис. 25 . Схема измерения рН раствора
Таким образом, электрическая цепь рН-метра состоит из ряда последовательно соединенных элементов, потенциалы которых дают суммарную ЭДС, фиксируемую измерительным прибором. Эта ЭДС является для определенной температуры функцией рН в исследуемом растворе.
В России наиболее широко используются рН-метры, выпускаемые Гомельским заводом измерительных приборов. В последнее время часто используют рН-метры разных модификаций производства Германии.
9.3 Контроль растворенного кислорода
Определение содержания растворенного кислорода в воде используют в большинстве случаев для оценки загрязнений, содержащихся в природных и сточных водах. Для этого используют два основных показателя: биохимическую потребность в кислороде (БПК) и химическую потребность в кислороде (ХПК).
БПК представляет собой кислородный эквивалент степени загрязненности воды органическими веществами. Существует несколько способов аналитического измерения БПК: метод разведения, нитратный, хлоратный и другие. На практике чаще всего применяют метод разведения. Сточную воду смешивают с частями разбавляющей воды. Смесь до предела насыщают растворенным кислородом, разливают в инкубационные склянки, герметизируют и оставляют в термостате при температуре 20°С на 5 и более суток. Величина уменьшения кислорода в склянке, умноженная на степень разведения, дает численную величину БПК.
ХПК - это количество кислорода, требуемое для окисления органических веществ в сточной воде до углекислого газа, воды и аммиака. Величина ХПК должна быть всегда больше, чем БПК. Чем меньше соотношение между БПК и ХПК, тем лучше очищена сточная вода.
Содержание кислорода в воде определяют кислородомерами. Наиболее удобными являются переносные кислородомеры марки «Оксимет 1».У этого прибора датчик погружается непосредственно в воду с помощью соединительного кабеля 3 (рис.26 .).
Датчик представляет собой защитную решетку 1, внутри которой располагается корпус с катодом и анодом, а также термометр
сопротивления 2.
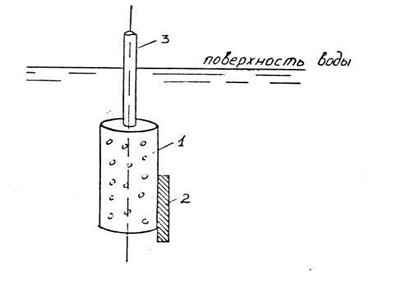
Рис.26 . Датчик кислородомера
Между электродами существует разность потенциалов от внешнего источника напряжения. Вследствие большой площади анода и малых токов, анод практически не поляризуется. Поэтому катод поляризуется на величину приложенного напряжения.
При определенном потенциале на катоде протекает реакция восстановления кислорода, что приводит к деполяризации катода.
Концентрация кислорода С определяется по формуле:
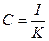 ,
,
где I - ток на катоде,
К - Коэффициент пропорциональности, зависящий от постоянных величин электрохимической системы прибора.
В последнее время появились различные модификации кислородо-меров: для лабораторных исследований - марки КЛ-115, стационарный промышленный прибор К-215 (оба выпускается Гомельским заводом измерительных приборов), анализатор кислорода АКВА-Л. Разработаны также инструментальные методы прямого определения БПК, основанные на изменении давления или объема газа. На использовании этих методов основана конструкция аппарата Варбурга [34]. Для этой же цели используют респирометры - аппараты, предназначенные для изучения дыхательной деятельности микроорганизмов. Существует также способ сценки концентрации органических веществ в воде путем измерения поглощения этой водой лучей ультрафиолетовой области спектра.
9.4. Определение редокс-потенциала.
Редокс-потенциал (окислительно-восстановительный потенциал) - этоодин из наиболее объективных показателей, характеризующих процессы биохимической очистки сточных вод. Величина редокс-потенциала (еН) полнее характеризует процессы биохимического окисления, чем, например, растворенный кислород. Кроме того, еН может дать более объективную оценку процесса очистки воды при наличии токсичных по отношению к микроорганизмам загрязнений.. Величина редокс-потенциала всех биохимических процессов, лежащих в основе жизнедеятельности живых организмов составляет 1250 мв (от -420 до +830 мв).
Величину еН измеряют электрометрическим методом. Электродная система состоит из платинового пластинчатого электрода и стандартного электрода сравнения (каломельного или хлорсеребряного). В некоторых случаях редокс-потенциал определяют с помощью индикаторного электрода из золота. Для измерений подходят электродные системы многих рН-метров и потенциометров, выпускаемых Гомельским заводом измерительных приборов.
9.5. Контроль щелочности воды
Щелочность природных вод характеризует в основном наличие в них бикарбонатных ионов. Она является одним из важнейших технологических показателей, по которому выбираются дозы целого ряда реагентов, используемых для обработки воды. В лабораторных условиях щелочность определяется титрованием 0,1н кислотой в присутствии индикаторов, изменяющихся окраску в области pH=4. Киевским институтом коллоидной химии разработано устройство для непрерывного автоматического измерения щелочности воды (рис. 27.)
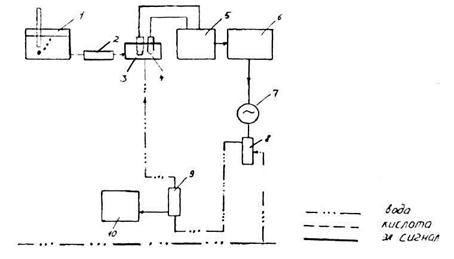
Рис.27 . Схема прибора для непрерывного автоматического измерения щелочности воды
Это устройство работает следующим образом. Из емкости 1 типа сосуда Мариотта через термостатированный капилляр 2 поступает в смесительную камеру 3 постоянное количество раствора кислоты. Туда же через регулирующий вентиль 7 и ротаметр 8 непрерывно поступает переменное количество исследуемой воды, при титровании с помощью электродной ячейки поддерживается значение рН смеси кислота-вода, соответствующее эквивалентной точке. При этом с помощью рН-метра 5 с опущенными в камеру электродами 4 измеряется величина ЭДС, поступающая на вход потенциометра 6. Если величина рН отклоняется от заданного значения, то изменяется количество воды, поступающей в камеру 3. Шкала ротаметра 5 градуируется по величине щелочности в мг-экв/л. Записывающее устройство 9 через вторичный прибор 8 осуществляет постоянную запись величин щелочности воды.
| <== предыдущая страница | | | следующая страница ==> |
| ПРИБОРНЫЙ КОНТРОЛЬ КАЧЕСТВА ПРИРОДНЫХ И СТОЧНЫХ ВОД ПО ПРЯМЫМ ПОКАЗАТЕЛЯМ | | | АНАЛИЗ ТВЕРДОЙ ФАЗЫ В ВОДЕ |
Дата добавления: 2014-10-02; просмотров: 867; Нарушение авторских прав

Мы поможем в написании ваших работ!