
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Транспортная функция мембран
Мембранный транспорт – важнейшая функция плазматической и внутриклеточных мембран всех живых клеток. Благодаря транспорту в клетку из окружающей среды поступают необходимые для жизнедеятельности метаболиты и устанавливается определенный состав внутриклеточной среды. Перенос и перераспределение веществ между субклеточными компартментами обеспечивает тонкую регуляцию концентрации молекул и ионов в клеточных структурах и наиболее благоприятное протекание в них метаболических процессов. Ионтранспортные системы мембран создают на них градиенты концентрации ионов, позволяющие запасать свободную энергию, которая может использоваться в различных физиологических процессах. В возбудимых клетках такие градиенты ионов являются источником энергии для генерации электрических сигналов и передачи информации между клетками.
Проникновение веществ через мембраны может осуществляться с помощью различных механизмов. Если транспорт сопровождается уменьшением свободной энергии системы, он носит название пассивного и протекает самопроизвольно. Перенос веществ, связанный с увеличением свободной энергии, является активным. Транспорт, сопряженный с химическими и транспортным процессами, в ходе которых свободная энергия в конечном счете уменьшается, называется вторично-активным. И, наконец, существует механизм транспорта, заключающийся в изменении структурной целостности мембран, так называемый транспорт в мембранной "упаковке".
Пассивный транспорт
Передвижение веществ при пассивной диффузии происходит по градиенту концентрации и направлено в сторону более низкой концентрации. Однако при прохождении веществ через мембрану есть препятствие – липидный бислой. Для его преодоления существует три способа.
1) транспортируемое вещество растворяется в липидном слое и диффундирует непосредственно через него;
2) диффузия осуществляется через каналы, пронизывающие мембрану;
3) в переносе веществ через мембрану участвуют молекулы-переносчики, облегчающие диффузию вещества через мембрану – облегченная диффузия.
Транспорт веществ через мембраны путем растворения их в липидной фазе, не связанный со специфическими белковыми структурами, представляет собой простую или неспецифическую диффузию. В принципе любая молекула за достаточно длительное время может пройти за счет диффузии через лишенный белков липидный бислой по градиенту концентрации. Однако скорости, с которыми различные молекулы диффундируют через такой бислой, очень сильно варьируют в зависимости от их размера и относительной растворимости в жирах. Как правило, чем меньше молекула и чем более она гидрофобна, тем быстрее она будет диффундировать через бислой. В то же время высокая степень гидратации, свойственная заряженным молекулам (ионам), препятствует их проникновению через углеводородные участки бислоя, в силу чего мембраны оказываются в значительной степени непроницаемыми для таких молекул независимо от их размеров.
Свободно диффундируют через липидные мембраны в первую очередь неполярные, жирорастворимые вещества. Этот процесс происходит также достаточно быстро для воды, газов О2, СО2, N2 и некоторых полярных молекул малого размера, например для этанола, мочевины. Полагают, что малые молекулы проникают через бислой вместе с кинками, возникающими в области дефектных зон мембраны, или водные поры. В широком диапазоне концентраций транспорт веществ через липидный бислой характеризуется пропорциональной зависимостью между трансмембранным концентрационным градиентом и скоростью проникновения их в клетку. Количественно способность молекулы растворенного низкомолекулярного вещества проникать через мембрану выражается коэффициентом проницаемости: чем больше проницаемость, тем больше скорость прохождения вещества при прочих равных условиях.
Проницаемость зависит от свойств мембраны и диффундирующего через нее вещества. Для низкомолекулярных соединений существенную роль играет коэффициент распределения между липидной и водной фазами, отражающий отношение растворимости вещества в неполярных растворителях к растворимости в воде. Поскольку спектр коэффициентов распределения для молекул весьма широк, то и коэффициент проницаемости варьирует достаточно сильно. Так, проницаемость мембран эритроцитов для различных веществ может колебаться в интервале от 10-12 до 10-2см/с.
Чтобы преодолеть границу раздела вода-липид, т.е. перейти из водной фазы в липидную, растворенная в воде молекула должна сначала разорвать все водородные связи, образованные у нее с водой, и далее раствориться в липидном бислое. Поскольку для разрыва водородных связей необходима энергия (5 ккал на моль водородных связей), проницаемость веществ тем меньше, чем больше водородных связей могут образовывать молекулы данного вещества. У неэлектролитов имеет значение, например, количество гидроксильных групп. Поэтому для многих небольших полярных молекул проникающая способность значительно ниже, чем для гидрофобных веществ. Что же касается крупных полярных незаряженных молекул, таких как глюкоза, сахароза и других сахаров, то они с трудом проходят через липидный бислой.
Для молекул, находящихся в ионизированной форме, т.е. несущих электрический заряд, фосфолипидный бислой мембран представляет собой еще более труднопреодолимый барьер. Заряженные молекулы и ионы Na+ K+, Са++, Сl- практически не могут проникать через искусственные мембраны путем простой диффузии. Тем не менее известно, что через природные мембраны про- и эукариотических клеток постоянно транспортируются заряженные вещества и ионы. Это наблюдение позволило заключить, что помимо простой диффузии должны существовать другие способы транспорта веществ, протекающие без затрат энергии.
К переносу заряженных и полярных молекул через биологические мембраны причастны специфические транспортные белковые системы. В частности, это доказано экспериментами на модельных мембранах. Если в искусственные мембраны, имеющие низкую проницаемость для неорганических ионов, добавить каналообразующие белки, экстрагированные из клеточных мембран, она становится близкой к проницаемости природных клеточных мембран
Опосредованные белками виды пассивного транспорта осуществляются в клеточных мембранах либо через каналы, либо при участии переносчиков. Остановимся на диффузии через мембранные каналы. Они встречаются как в плазматической мембране клеток, так и в мембранах ряда органоидов: митохондрий, саркоплазматического ретикулума и др. В возбудимых мембранах нервных и мышечных клеток обнаружены сходные по функциям каналы для Na+, K+, Са++.
Каналы представляют собой туннели, построенные из белковых комплексов. В полость каналов, заполненных водой, выступают полярные группы белковых молекул (рис.3). Заряд и структура мест связывания иона в стенках канала определяют их избирательность, или селективность. Она выражается в том, что отдельные типы каналов облегчают транспорт одних молекул и предотвращают проникновение через мембрану других. Так, каналы, пропускающие катионы, выстланы отрицательно заряженными группами, препятствующими прохождению через них анионов. Наоборот, вдоль стенок анионного канала находятся фиксированные положительные заряды, не пропускающие катионы. Относительная избирательность каналов зависит не только от заряда, но также от размеров и степени гидратации иона. Существуют, например, калиевые, натриевые и кальциевые каналы, каждый из которых проницаем только для специфического иона.
Калиевый канал
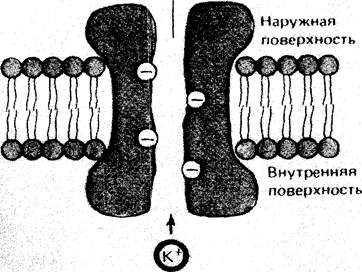
Рис.3. Схематическое изображение белкового канала для калия
Канальные белки в процессе переноса растворимых веществ с одной стороны мембраны на другую не претерпевают конформационных изменений, а конформационные перестройки регулируют лишь открывание или закрывание каналов в ответ на химический или электрический сигнал. Каналы, регулируемые напряжением электрического поля, открываются или закрываются при изменении трансмембранного потенциала электровозбудимых клеток. К их числу, в частности, относятся потенциалзависимые натриевый канал, обеспечивающий деполяризацию при развитии потенциала действия в нервных и мышечных клетках, и кальциевый канал, открывание которого в синапсах сопровождается высвобождением нейромедиаторов. Химически регулируемые каналы отвечают на действие специфических химических агентов. Так, ацетилхолиновый рецептор при связывании с ним медиатора переходит в открытую конформацию, пропуская одновалентные катионы. Благодаря тому, что канальные белки при переносе иона с одной стороны мембраны на другую не претерпевают конформационных изменений, они обладают высокой мембранной проводимостью (106-108ион/с на один канальный белок).
Следует заметить, что наряду с термином "каналы" часто используется термин "пора". Однако, как правило, под порой подразумевают неселективные структуры, которые различают вещества главным образом по размеру и пропускают все достаточно мелкие молекулы, а под каналами обычно понимают ионные каналы.
Перенос через мембрану электролитов, образующих при диссоциации заряженные частицы, зависит не только от концентрационного градиента, как это имеет место для электрически нейтральных молекул, но и от трансмембранной разности электрических потенциалов. Пассивная диффузия ионизированных частиц, таких как аминокислоты, ионы Na+, K+, Са++ и Сl-, будет определяться, следовательно, одновременным действием двух движущих сил: химического градиента и электрических сил, в сумме называемых электрохимическим градиентом.
Для моделирования и изучения трансмембранного транспорта ионов используются природные и синтетические соединения, включающиеся в мембраны и модифицирующие ионный транспорт. Такие вещества могут действовать в качестве мобильных переносчиков, так называемых ионофоров, а также образовывать в мембране водные поры (каналы). В последнем случае их называют каналообразователями или ионопроводами. Термин "ионофоры" был предложен в 1968 году Прессманом для обозначения веществ, увеличивающих проницаемость мембран для ионов. Ионофоры представляют собой гидрофобные вещества, образующие с катионами щелочных и щелочноземельных металлов жирорастворимые комплексы, способные проникать через мембрану путем диффузии. Многие ионофоры являются антибиотиками, выделенными из микроорганизмов или синтезированными искусственно.
Все переносчики имеют заряженные или полярные группы, с помощью которых может быть образован хелатный комплекс с ионом. Другая часть молекулы переносчика обладает гидрофобностью, позволяющей ему вступать во взаимодействие с липидами мембран и осуществлять движение внутри мембраны.
Комплекс ионофора с ионом металла образуется после удаления гидратной оболочки. Это происходит в результате взаимодействия между ионами и полярными группами переносчика, являющегося более сильным, чем взаимодействие между ионом и растворителем. Процесс протекает в несколько последовательных этапов, в ходе которых переносчик охватывает ион со всех сторон.
Например, макроциклический антибиотик валиномицин, состоящий из 6 амино - и 6 оксикислот, в водной среде имеет конформацию, при которой отрицательно заряженные карбоксильные группы направлены во внешнюю среду. Когда появляется катион К+, карбоксильные группы устремляются к нему, образуя 6-8 координационных связей между кислородными атомами ионофора и ионом металла. Так происходит постепенное вытеснение ассоциированных с ионом молекул воды, приводящее к снижению энергетического барьера проникновения ионов в мембрану.
В результате разрыва одних связей и образования других претерпевает изменение конформация молекулы валиномицина, сопровождающееся свертыванием молекулы вокруг иона К+ (рис.4). При этом неполярные группы ионофора направляются наружу, а ион оказывается заключенным в мешок с полярным содержимым и неполярным внешним чехлом. Комплекс К+-валиномицин со стехиометрией 1:1 мигрирует к другой стороне мембраны, где ион калия освобождается, а свободная молекула валиномицина возвращается обратно. Таким образом, процесс переноса с участием ионофора протекает в три стадии:
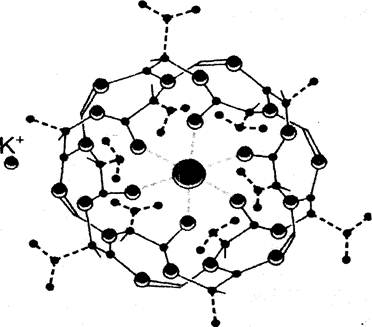
Рис.4. Структура комплекса К+- валиномицин
1) взаимодействие переносчика с ионом;
2) диффузия переносчика с ионом через мембрану;
3) освобождение иона на противоположной стороне мембраны.
Циклически повторяющиеся конформационные переходы молекулы переносчика обеспечивают транспорт иона калия без затрат энергии. Перенос К+ с помощью валиномицина характеризуется очень высокой специфичностью, антибиотик связывает ионы K+ в 10000 эффективней, чем ионы Na+. Существенную роль здесь играет радиус иона: переносчик способен не только узнавать ион по его радиусу, но и исключать как меньшие, так и большие размеры молекул. Аналогичным образом комплексы с одновалентными катионами образуют нигерицин (селективно связывает К+) и моненсин (селективно связывает Na+).
Каналообразование осуществляется при участии антибиотиков, обладающих амфифильными свойствами, позволяющими им, с одной стороны, встраиваться в мембрану и, с другой, – образовывать водные поры. К ним относятся ионизированные молекулы с незамкнутой цепью, в частности грамицидин, аламетицин и полиеновые антибиотики. Такие молекулы имеют достаточную длину, чтобы пронизывать мембрану насквозь. Однако чаще всего в образовании канала участвует несколько молекул антибиотика. Молекулы этого типа содержат сильнополярные и заряженные группы, в частности карбоксильные, группирующиеся на одном конце молекулы и образующие своего рода туннель в центре канала.
Наиболее полно в настоящее время изучены каналы, образуемые грамицидином А – пептидом, состоящем из 15 гидрофобных аминокислот. Встраиваясь в мембраны, он обеспечивает неселективную проницаемость для ряда одновалентных катионов, но не пропускает даже мелкие анионы, как например ионы Сl-. Предполагается, что канал представляет собой пептидный димер, у которого все гидрофобные боковые группы находятся снаружи, а гидрофильные карбонильные группы направлены внутрь канала (рис.5).
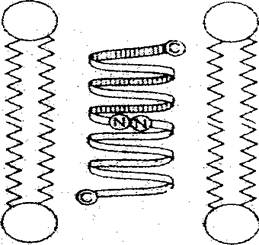
Рис.5. Схематическое изображение канала,
образуемого грамицидином
В момент вхождения в канал транспортируемый ион частично дегидратируется за счет взаимодействия с карбонильными группами грамицидина А вместо утраченных при дегидратации молекул воды, однако размеры канала позволяют проходить через него и нескольким молекулам воды.
В отличие от грамицидина А, образующего пору внутри пептидной спирали, аламетицин формирует ее путем агрегации нескольких молекул (рис.6). Такая пора содержит изнутри полярные атомы и наполнена водой.

Рис.6.Схематическое изображение канала,
образуемого аламетициновыми олигомерами
Полиеновые антибиотики, представляющие собой мембраноактивные противогрибковые препараты, легко взаимодействуют со стероидами мембраны с формированием каналов, что приводит к утечке важных для жизнедеятельности грибов ионов и других компонентов цитоплазмы. Полость канала образована цилиндром, содержащим, например у нистатина, 8-10 молекул антибиотика. Внутри канала находятся гидрофильные участки молекулы, снаружи – неполярные группы полиена, связанные с молекулами стерола (рис.7). Каналы заполнены водой и пропускают через себя не только одновалентные ионы, но и небольшие молекулы неэлектролитов.
Каналообразователи по ряду признаков отличаются от истинных ионофоров. Так, транспорт ионов, осуществляемый с помощью ионофоров, резко падает до нуля при понижении температуры, индуцирующем фазовый переход мембран. В то же время антибиотики, образующие каналы, продолжают эффективно функционировать и при температурах более низких, чем температура фазового перехода. Заметное влияние микровязкости мембран на диффузию ионов с помощью ионофоров свидетельствует о том, что условием их функционирования является достаточная подвижность молекулы в липидном бислое.
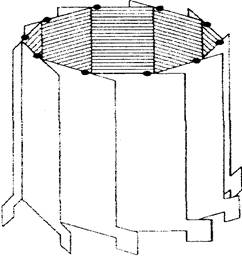
Рис.7. Схематическое изображение канала,
образуемого полиеновыми антибиотиками
Изучение моделей каналов, образуемых антибиотиками, в значительной мере позволило расшифровать молекулярную организацию каналов в клеточных мембранах. В настоящее время детально охарактеризованы такие каналы, как натриевый канал, канал ацетилхолинового рецептора и др. Выяснилось, что наиболее часто структурно-молекулярной основой каналов является симметричная организация из α-спиральных субъединиц белка (или отдельных доменов одной субъединицы) вокруг центрального отверстия.
Многие вещества имеют свои специфические переносчики, ускоряющие их диффузию через мембрану по концентрационному или электрохимическому градиенту. Такой вид транспорта получил название облегченной или опосредованной диффузии. В процессе транспорта различных веществ конформация переносчиков претерпевает изменение, а место связывания переносимого вещества в любой момент времени доступно только с одной стороны мембраны, т.е. обращено сначала к одной, затем к противоположной стороне мембраны. Обычно опосредованный переносчиками транспорт происходит на несколько порядков медленнее, чем транспорт по каналам.
Системами облегченной диффузии обладают плазматические мембраны клеток млекопитающих для таких метаболитов, как сахара, аминокислоты, пурины и глицерин. Было показано, что процесс переноса глицерина и глюкозы через эритроцитарные мембраны человека сильно отличается от обычного пассивного транспорта и характеризуется более низкой энергией активации, чем это вытекает из теоретических расчетов. Подобные наблюдения позволили заключить, что их путь не проходит непосредственно через углеводородный скелет липидов, образующих мембраны, а осуществляется при участии специальных переносчиков белковой природы.
Процесс транспорта веществ через мембраны при участии переносчиков протекает в несколько этапов:
1) специфическое узнавание и связывание транспортируемого вещества с переносчиком;
2) последующая транслокация вещества через мембрану;
3) диссоциация комплекса вещество-переносчик на другой стороне мембраны.
Облегченную диффузию характеризует ряд особенностей. В отличие от простой диффузии, зависимость скорости переноса от концентрации транспортируемого вещества сохраняет линейность только при низких концентрациях вещества. Затем скорость поступления вещества выходит на плато и дальнейшее увеличение его концентрации не приводит к росту скорости, т.е. имеет место "эффект насыщения". Это явление объясняется ограниченностью числа молекул переносчика: скорость опосредованной диффузии достигает максимума, когда все молекулы переносчика заняты молекулами транспортируемого вещества. В общих чертах кинетика опосредованного переносчиком пассивного транспорта соответствует кинетике ферментативной реакции, что подтверждает белковую природу молекулы переносчика.
Опосредованный транспорт отличается высокой специфичностью, в частности стереоспецифичностью. Переносчики различают, например, Д и L изомеры сахаров и аминокислот. Следовательно, в молекуле переносчиков присутствуют специфические центры узнавания и связывания транспортируемых веществ, подобные активному центру ферментов.
Особенностью процесса облегченной диффузии является также ингибирование транспорта по конкурентному и неконкурентному типу. При конкурентном ингибировании, например фосфорорганическими соединениями, возникает конкуренция с транспортируемым веществом за специфический центр связывания. Неконкурентные ингибиторы, в том числе ионы тяжелых металлов, изменяют конформацию центра связывания. Как видно, не только кинетика транспорта при опосредованной диффузии, но и его механизмы во многом сходны с функционированием ферментов.
Наиболее сложным является вопрос о том, каким образом белки-переносчики обеспечивают прохождение различных молекул через мембраны. Существует несколько моделей, объясняющих движение белковых переносчиков в мембране:
1) белок-переносчик вместе со связанным веществом (лигандом) может перемещаться с одной стороны мембраны на другую в результате физической диффузии, осуществляя так называемое челночное движение;
2) функцию переносчика выполняет крупная белковая молекула, диаметр которой соизмерим с толщиной мембраны. Перенос вещества в этом случае происходит благодаря вращательной диффузии;
3) белки, интегрированные в мембрану, претерпевают конформационные превращения достаточно высокой амплитуды, способной обеспечить перенос вещества через мембрану. Возможны сочетания этих способов переноса и другие варианты.
Функционирование системы облегченной диффузии, направленной на снижение градиента концентрации веществ, должно в итоге привести к выравниванию градиентов и установлению равновесия в системе. Однако вещества, проникающие в клетку таким путем, довольно часто являются активными метаболитами в процессах, протекающих по одну сторону мембраны, что постоянно поддерживает трансмембранную разницу их концентраций. Системы с облегченной диффузией, влияя на скорость поступления в клетку и ее структуры веществ, служащих отправными точками метаболизма, выступают в качестве важнейших регуляторов обменных процессов в клетках.
Перенос воды
Скорость диффузии воды через биологические мембраны очень высока (время полуоборота составляют миллисекунды). Причем вода проникает через клеточные мембраны гораздо легче, чем следует из ее коэффициента распределения, и примерно в 10 раз быстрее, чем через модельные мембраны. Это дает основание предполагать наличие в мембране каналов, или пор. Однако представление о порах носит условный характер и вводится для удобства: размеры пор соизмеримы с размерами молекул воды. Маленькие незаряженные молекулы воды могут быстро проникать через бислой вместе с кинками, возникающими в области дефектных зон – это "липидный" путь. Увеличение вязкости мембран, например при включении в них холестерина, сопровождается снижением проницаемости для воды.
Кроме того, существует "белковый" путь переноса воды, о чем свидетельствует ослабление потока воды через мембраны при ингибировании SH-групп. Считается, что в эритроцитах проницаемость мембран для воды осуществляется главным образом через канал, образуемый белком анионного переносчика.
В большинстве случаев перемещение воды через клеточные мембраны вызывается гидростатическим или осмотическим давлением. Осмос – основная движущая сила при транспорте воды через мембраны живых клеток – возникает вследствие разницы концентраций по обе стороны мембраны растворенных веществ, для которых мембрана менее проницаема, чем для воды. Молекулярный кислород и углекислый газ проходят через мембраны в растворенном состоянии, поэтому скорость их переноса определяется растворимостью в водной среде.
Активный транспорт
Диффузия через липидный бислой или каналы в мембране и облегченная диффузия – это пассивные процессы, в ходе которых высвобождается потенциальная энергия, запасенная в форме разности концентраций вещества на противоположных сторонах мембраны. В результате происходит выравнивание концентраций веществ относительно поверхности клеточной мембраны.
В клетках наряду с транспортом веществ по концентрационному и электрохимическому градиенту широко представлен и перенос, который осуществляется против градиентов. Благодаря ему в живых клетках поддерживается неравновесная трансмембранная разность концентраций многих растворенных веществ. Например, концентрация ионов натрия в плазме крови составляет 144ммоль/л, а в эритроцитах – 26ммоль/л, в мышцах – 12ммоль/л. Распределение ионов калия противоположно: в плазме крови их содержание равно 5ммоль/л, в эритроцитах – 150ммоль/л и в мышцах – 155ммоль/л. И тем не менее передвижение ионов идет против градиента концентрации – калий поступает в клетку, а натрий выходит из нее. Такой вид транспорта называется активным (насосом), а переносчики, создающие трансмембранные ионные градиенты, – активными переносчиками.
В отличие от облегченной диффузии, при которой перенос идет без прямой затраты метаболической энергии, активный транспорт постоянно потребляет энергию. Поэтому транспорт веществ должен быть сопряжен с другим, запасающим свободную энергию процессом. Многие первичные активные переносчики являются ионными насосами, в которых перемещение иона прямо сопряжено с поставляющей энергию химической реакцией. В настоящее время охарактеризовано значительное число систем, в которых энергия, необходимая для переноса тех или иных веществ через мембраны, высвобождается в ходе гидролиза макроэргических фосфатных связей АТФ или фосфоенолпирувата. Причем, если отключить источник энергии, то активный транспорт прекратится. В этом случае распределение вещества, для которого мембрана проницаема, будет осуществляться пассивно, и его внутриклеточная концентрация будет уравниваться с внеклеточной.
Известны мембраны, использующие для активного транспорта и другие виды энергии. Примером могут служить ферменты, которые функционируют как ионные насосы за счет изменения окислительно-восстановительного состояния связанной с белком простетической группы. Так, цитохром-с-оксидаза внутренней митохондриальной мембраны, катализирующая окисление цитохрома с и восстановление O2 до воды, реакцию переноса электронов осуществляет сопряженно с транспортом протонов. Бактериородопсин пурпурной мембраны представляет собой насос, в котором перенос протонов через бактериальную мембрану сопряжен с поглощением фотонов видимого света.
В большинстве случаев ионные насосы являются электрогенными: перемещение заряженных частиц приводит к разделению электрических зарядов, создающем мембранный потенциал.
Необходимость использования больших количеств энергии для поддержания активного транспорта предъявляет высокие требования к интенсивности метаболизма клетки. В отдельных случаях на активный транспорт может затрачиваться практически вся энергия, вырабатываемая в клетке. Какова же роль систем активного транспорта в клетке?
Возможность транспортировать вещества против концентрационных градиентов позволяет клеткам извлекать разные питательные вещества из окружающей среды даже при крайне низкой их концентрации в среде. В некоторых случаях это приводит к полному удалению потребляемых соединений из окружающей среды, как например из питательных сред, в которых культивируются бактерии, или из содержимого кишечника. Кроме того, благодаря способности поддерживать стационарные концентрации участвующих в метаболизме веществ независимо от возможных резких колебаний во внешней среде, активный транспорт принимает участие в регуляции метаболизма.
В нервных и мышечных клетках градиент электрохимического потенциала ионов Na+ и К+, создаваемый натриевым насосом, используется при генерации потенциала действия и в дальнейшей передаче информации в виде электрических импульсов. В невозбудимых клетках натриевый насос обеспечивает регуляцию объема клеток, сохранение стабильного осмотического давления и требуемого состава электролитов.
Во многих клетках животных кальциевый насос поддерживает чрезвычайно низкий уровень ионов Са++ в цитоплазме, откачивая их во внеклеточную жидкость или внутриклеточные депо, например в эндоплазматический ретикулум. Механизм ограничения концентрации Са++ в цитоплазме покоящихся клеток создает возможность регуляции многих внутриклеточных процессов, которые инициируются кальцием, путем увеличения проницаемости мембран для этих ионов. К числу процессов, контролируемых или запускаемых кальцием, относятся, в частности, секреция медиаторов в синапсах, клеточное деление, окислительное фосфорилирование и др. В волокнах поперечно-полосатой мышечной ткани ионы Са++, высвобожденные при нервном импульсе, взаимодействуют с регуляторными белками миофибрилл, вызывая мышечное сокращение. Последующее удаление кальциевым нососом ионов Са++ в полость саркоплазматического ретикулума приводит к расслаблению мышцы.
Молекулярная организация и механизм действия многих систем активного транспорта изучены достаточно хорошо. Среди них наиболее полно описаны ионпереносящие АТФазы, ферменты, с помощью которых происходит сопряжение транспорта тех или иных ионов через мембрану с гидролизом макроэргической фосфатной связи АТФ. Довольно широко распространенным мембранным насосом является натриевый насос. Он встречается в плазматических мембранах клеток различных органов животных, у простейших, в клетках высших и некоторых низших растений. Но особенно много фермента в возбудимых тканях животных и, прежде всего, в органах, выполняющих электрическую работу (мозг, электрический орган), а также в органах, осуществляющих выделительную функцию (почки, солевая железа морских птиц).
Молекулярный механизм выхода натрия из клетки и накопления в ней калия был выяснен в 1957 году, когда Скоу в Дании в мембранной фракции нерва краба обнаружил Mg-зависимую АТФазную активность, которая сильно стимулировалась ионами Na+ и К+. Оказалась, что эта активность подавляется в присутствии гликозида уабаина, специфического ингибитора натриевого насоса.
Фермент представляет собой олигомер, состоящий из субъединиц двух типов: большей a-субъединицы и меньшей b-субъединицы. В молекуле Na+,K+-ATФазы имеются специальный участок связывания ионов натрия и калия, а также гидролитический центр, расположенные в гидрофильном окружении в тех частях молекулы, которые выступают из бислоя. Центральная часть фермента, включающая 10 a-спиральных участков a-субъединицы и один – b-субъединицы, находится в гидрофобном окружении фосфолипидов мембраны (рис.8).
Транспорт ионов обеспечивается циклическими конформационными изменениями белкового комплекса, происходящими с затратами энергии. Фермент (Е) существует, по меньшей мере, в двух конформациях, различающихся по сродству к субстратам. В одной конформации, характеризующейся высоким сродством к Na+ (конформация Е1), но низким – к К+, места связывания ионов обращены в сторону цитоплазмы. В другой форме (высокое сродство к К+ и – низкое к Na+, конформация Е2) центры связывания направлены наружу. Фермент легко взаимодействует с АТФ, образуя фосфорилированный фермент (Е-Р, где Р-фосфорильный остаток).
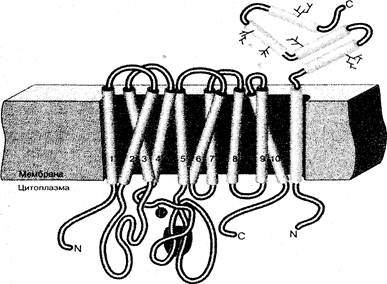
Рис. 8. Строение Na+,K+-ATФазы
На первом этапе происходит связывание на цитоплазматической стороне мембраны трех ионов натрия, взаимодействие с АТФ и образование фосфорилированной формы фермента. Фосфорилирование белка стабилизирует конформацию с низким сродством к Na+. Это способствует переходу EP1—>EP2. Синхронно с информационным переходом фермента происходит перенос ионов натрия через мембрану. В новой конформации фермента, обладающей высоким сродством к К+, места связывания ионов обращены во внеклеточную среду. На следующем этапе каталитического цикла связываются два иона калия, фермент дефосфорилируется и переходит в исходную форму.
Специфическое связывание катионов с ионным центром Na+,K+-ATФазы, расположенном в a-субъединице фермента, происходит благодаря их взаимодействию с атомами кислорода карбоксильных групп белковой молекулы. Конформационное превращение белка при переходе EP1—>EP2 (и обратно) обеспечивает перестройку ионных центров, изменяя их сродство к транспортируемым ионам и доступность с разных сторон мембраны.
Активный транспорт, как и облегченная диффузия, подчиняется кинетике с насыщением и испытывает конкурентное ингибирование. АТФ – основной источник энергии для работы натриевого насоса образуется в основном в результате реакций окислительного фосфорилирования, сопряженного с дыханием в митохондриях клеток. При блокировании клеточного дыхания или гликолиза такими ингибиторами, как фториды, арсенаты, цианиды, а также при разобщении дыхания и окислительного фосфорилирования, например динитрофенолом, происходит выравнивание концентраций натрия и калия по обе стороны мембраны.
Существенную роль в функционировании Na+,K+-ATФазы играют окружающие фермент липиды. Удаление некоторых липидов (в первую очередь фосфатидилсерина) из мембранных препаратов, их замена другими молекулами приводит к полной или частичной инактивации фермента. Предполагают, что роль липидов сводится к стабилизации положения молекулы в мембране, их участию в формировании активных центров фермента и обеспечению конформационных превращений. Вполне вероятно, что липиды определяют видовые и органные отличия в работе Na+,K+-ATФазы из различных мембран.
Активные АТФ-зависимые транспортные системы эукариотических клеток осуществляют перенос ионов не только через плазматическую, но и внутриклеточные мембраны. Так, известны АТФазы, участвующие в транспорте H+ через внутреннюю митохондриальную мембрану, мембрану тилакоидов хлоропластов, мембраны вакуолей и тонопластов растений и лизосом. Са++-АТФаза переносит ионы кальция как через плазматическую мембрану, так и через мембрану саркоплазматического ретикулума. У прокариотических клеток наиболее распространенным является активный транспорт через мембрану H+.
Несмотря на большое разнообразие первичных активных транспортных систем, их молекулярная организация и механизм работы имеют много общего. Структурную основу различных насосов составляют интегрированные в мембрану белки со сходными аминокислотными последовательностями. Большинство моделей, описывающих сопряжение химических реакций и транспорта различных ионов через мембрану, опираются, как и модель работы натриевого насоса, на концепцию чередования конформационных изменений молекулы активного переносчика. В этой связи многие мембранные АТФазы весьма чувствительны к вязкости липидного окружения. Рост вязкости липидного бислоя препятствует, в первую очередь, движению участков фермента, осуществляющих перенос ионов с одной стороны мембрану на другую.
Увеличению вязкости мембраны, а, следовательно, и снижению активности мембраносвязанных ферментов способствует избыточное накопление холестерина, изменение жирнокислотного состава мембранных фосфолипидов и усиление их перекисного окисления.
Вторично-активный транспорт
У многих клеток обнаружена способность накапливать различные вещества с помощью зависимого от энергии активного транспорта. У бактерий найдено несколько систем переноса различных аминокислот, отличающихся высокой специфичностью. Для их переноса необходимы экзогенные ионы натрия. Причем способность системы переносить в клетку аминокислоты выражена тем сильнее, чем выше концентрация ионов Na+ во внеклеточной среде. Следовательно, наличие уменьшающегося внутрь клетки градиента концентрации натрия служит движущей силой переноса в клетку аминокислот против градиента концентрации. В свою очередь, градиент концентрации ионов Na+, направленный внутрь клетки, формируется за счет энергии гидролиза АТФ под действием активно работающей Na+,K+-АТФазы.
Аналогичные механизмы переноса обнаружены не только у бактерий, но и у эукариотических клеток. Например, накопление аминокислот и сахаров, зависящее от присутствия ионов Na+ во внешней среде, происходит в эпителиальных клетках кишечника и почечных канальцев.
Такой "принудительный" транспорт веществ в клетку против градиента их концентрации объясняется наличием в мембране белковых переносчиков, способных связывать одновременно как молекулы глюкозы или аминокислот, так и ионов Na+. В итоге переносчик облегчает поступление в клетку молекул веществ совместно с ионами Na+, которые движутся пассивно, по градиенту концентрации, создаваемой работой натриевого насоса. Полагают, что в тонком кишечнике молекула переносчика локализована на апикальной стороне клетки, т.е. обращена в просвет кишечника. В противоположной, базальной части клетки, расположен натриевый насос, откачивающий ионы Na+ из клетки.
Движущей силой для переноса веществ может служить и протонный электрохимический градиент, генерируемый электронтранспортной цепью. Наиболее полно охарактеризованным примером такого рода является перенос лактозы в Escherichia coli.
В тех случаях, когда через мембрану одновременно и однонаправлено переносятся два разных вещества (например, протоны и лактоза; Na+ и глюкоза), транспорт называется симпорт. Антипортеры осуществляют одновременный транспорт веществ в противоположных направлениях. Примером является перенос ионов кальция из клетки в обмен на входящие в нее по градиенту концентрации и потенциала ионы натрия. Симпорт и антипорт относят к котранспорту – взаимозависимому транспорту ионов или молекул веществ через мембрану, в отличие от унипорта, под которым подразумевают транспорт ионов или молекул независимо от транспорта других соединений (рис. 9).
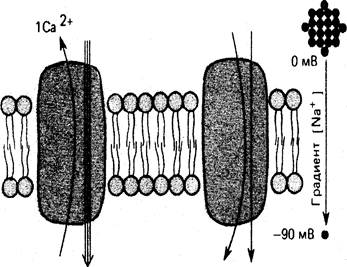
З Na+ 1 молекула глюкозы 1 Na+
Ca++-Na+-антипорт Симпорт глюкозы и Na+
Рис.9. Схема симпорта и антипорта
Транспорт в мембранной "упаковке"
Для некоторых веществ, поступающих в клетку или выходящих из нее, отсутствуют транспортные белковые системы, и они проходят через плазматическую мембрану в особых пузырьках – везикулах. Такой способ поглощения клеткой крупных молекул и частиц и их выделения получил название цитоза. Его можно подразделить на эндоцитоз и экзоцитоз. Эндоцитоз – это проникновение в клетку внеклеточного материала (например, макромолекул) в составе мембранных пузырьков. При экзоцитозе везикулы, заполненные синтезированным в клетке веществом, доставляются к плазматической мембране и сливаются с ней, в результате чего содержимое везикул оказывается во внешней среде. В обеих системах происходит перенос специфических мембранных компонентов между мембранами внутри клетки с помощью везикул, которые отшнуровываются от одной мембраны и сливаются с другой. Активное участие в этих процессах принимают мембраны эндоплазматического ретикулума, комплекса Гольджи и лизосом.
Эндоцитоз можно рассматривать как универсальное явление, свойственное любым клеткам. Таким путем в клетки могут поступать питательные вещества, например белки, полисахариды, полинуклеотиды. Но наибольшее значение эндоцитоз имеет в клетках простейших, печени, крови, макрофагах, злокачественных и эмбриональных клетках. Скорость эндоцитоза в таких клетках достаточно велика. Так, измерения, проведенные на гепатоцитах, показали, что они поглощают путем эндоцитоза за 1 час количество жидкости, составляющее не менее 20% их клеточного объема и количество мембранного материала по площади, превышающей в пять раз площадь их базолатериальной плазматической мембраны.
Разграничивают процессы поглощения клеткой крупных частиц и жидкости. В первом случае речь идет о фагоцитозе, описанном Мечниковым, во втором – о пиноцитозе. С помощью пиноцитоза, присущего практически всем животным клеткам (в силу этого нередко под термином эндоцитоз подразумевается именно пиноцитоз), в них поступают растворенные в жидкости внеклеточные химические компоненты. При фагоцитозе, свойственном таким специализированным клеткам, как макрофаги и нейтрофилы, поглощаются бактерии, клетки, их обломки и другие крупные частицы. У простейших фагоцитоз – это форма питания клетки; у многоклеточных он представляет собой ключевой механизм защиты организма хозяина от микроорганизмов и осуществляется «профессиональными» фагоцитами. Кроме того, макрофаги играют важную роль в утилизации старых или поврежденных клеток и клеточных обломков, необходимой для обновления ткани и заживления ран.
В отличие от пиноцитоза, конститутивного процесса, характеризующегося постоянным динамическим образованием инвагинаций и небольших пузырьков на поверхности клеток, фагоцитоз индуцируется при взаимодействии молекулы или частицы с поверхностным рецептором. Специализированные рецепторы на плазматической мембране «профессиональных» фагоцитов, предназначенные для распознавания поглощаемых частиц или молекул, функционально связаны с фагоцитозным аппаратом клетки. В качестве индукторов фагоцитоза могут выступать, например, антитела. При этом рецепторы узнают неантиген-связывающие участки иммунноглобулинов и запускают фагоцитоз.
Активированные рецепторы генерируют и передают сигналы внутрь клетки, инициируя сокращение элементов цитоскелета. Основную роль здесь играет перестройка актиновых микрофиламентов, заключающаяся в полимеризации глобулярного G-актина в волокна F-актина. Считается, что актин-зависимый механизм лежит в основе как образования инвагинаций плазматической мембраны и формирования псевдоподий, так и их дальнейшего активного движения. Вещества, разрушающие микрофиламенты субмембранной системы (например, цитохалазин, препятствующий полимеризации актина), нарушают течение фагоцитоза.
Способностью захватывать микроорганизмы обладают и фибробласты. Поскольку на их поверхности отсутствуют рецепторы, свойственные «профессиональным» макрофагам, связывание инородных частиц они осуществляют с помощью рецепторов для белков внеклеточного матрикса: коллагена, фибронектина, ламинина.
При поглощении жидкости в процессе пиноцитоза обычно образуются небольшие пузырьки диаметром около 150нм. В случае фагоцитоза размеры пузырьков, называемых фагосомами, значительно крупнее и могут превышать 250нм. Как правило, их диаметр определяется размерами поглощаемой частицы.
Отшнурованные от мембраны везикулы, сливаясь с другими мембранными структурами, переносят свое содержимое во внутриклеточные компартменты. При пиноцитозе мелкие инвагинации и пузырьки с растворенными веществами поглощаются и сливаются с другими пузырьками, находящимися близко к поверхности, и формируют промежуточные мембранные органеллы – эндосомы.
Характерной особенностью пиноцитоза является непрерывное образование в специализированных областях плазматической мембраны окаймленных ямок. Отличительная их черта заключается в наличии на цитоплазматической поверхности пентагональной или гексагональной решетчатой структуры из молекул белка клатрина, которая образуется путем самосборки. На долю этих ямок приходится 1-2% общей площади поверхности плазматической мембраны, они формируются примерно в течение минуты и затем втягиваются в клетку. После отрыва образующегося впячивания от клеточной поверхности формируется везикула, окруженная ячеистой клатриновой оболочкой и называемая окаймленным пузырьком. Время жизни таких пузырьков даже меньше, чем у ямок, они быстро теряют свое покрытие и сливаются с эндосомами. Клатрин, отделившийся от мембраны пузырька, возвращается в плазматическую мембрану для образования новых окаймленных ямок.
Как эндосомы, так и фагосомы чаще всего сливаются с лизосомами, содержащими гидролитические ферменты. В лизосомах происходит расщепление макромолекул до мономеров, которые диффундируют из везикул в цитозоль и используются клеткой. Часть поглощенных мембранных компонентов эндоцитозных пузырьков и фагосом возвращается с помощью экзоцитоза обратно в плазматическую мембрану и там повторно утилизуется. В некоторых макрофагах пептиды, образующиеся при деградации поглощенных белков, возвращаются на клеточную поверхность, связываясь с гликопротеидами главного комплекса гистосовместимости. В случае чужеродного происхождения пептидов, макрофаги выступают в качестве антиген-представляющих клеток.
Во многих животных клетках выделяют еще одну разновидность транспорта в мембранной "упаковке" – специфический или опосредованный рецепторами эндоцитоз. С его помощью обеспечивается поступление в клетку большой группы соединений, не способных проходить по мембранным каналам: иммуноглобулинов, липопротеинов, факторов роста, некоторых цитокинов, железосодержащих белков и других веществ. Таким путем в клетку могут проникать также некоторые вирусы и токсины.
При рецепторно-опосредованном эндоцитозе клетки экспрессируют белки-рецепторы, которые встраиваются в плазматическую мембрану и связываются на ее поверхности со специфическими макромолекулярными лигандами. К последним относятся транспортные белки, доставляющие клеткам питательные вещества, как например липопротеины низкой плотности, и сигнальные молекулы: эпидермальный фактор роста, фактор роста тромбоцитов, инсулин.
Большинство рецепторов концентрируются в окаймленных ямках, окруженных с цитозольной стороны мембраны ячеистым клатриновым покрытием. Сродство рецепторов к таким ямкам может быть, как у рецепторов липопротеинов низкой плотности, постоянным. Появившись в мембране, они диффундируют в ней до тех пор, пока не встретятся с формирующейся окаймленной ямкой и не включатся в ее состав. В других случаях рецепторы не двигаются к окаймленной ямке до тех пор, пока не свяжутся с лигандом. В частности, рецепторы эпидермального фактора роста в несвязанном состоянии диффузно распределены по поверхности мембраны, но начинают быстро перемещаться к ямке после связывания с рецептором.
Затем края ямок смыкаются и они отпочковываются внутрь клеток, образуя окаймленные пузырьки. В отпочковыванных эндоцитозных везикулах оболочка из клатрина удаляется специфическим белком в ходе АТФ-зависимой реакции. В дальнейшем лишенные клатрина пузырьки высвобождают свое содержимое в эндосомы, которые в большинстве случаев сливаются с первичными лизосомами с образованием вторичных лизосом, где и происходит деградация захваченного клеткой материала (рис. 10). Полагают, что клатрин выполняет несколько функций: связывает занятые лигандом молекулы рецептора и участвует в последующем отшнуровывании везикулы от поверхности мембраны. Кроме того, существует предположение, что окаймленные пузырьки могут участвовать в процессе узнавания своей мишени – соответствующего акцепторного компартмента.
Важнейшей особенностью эндоцитозных везикул является наличие в мембране протонных АТФаз, закисляющих их содержимое до рН 5,0-6,2. При столь низких рН происходит диссоциация комплексов рецептор-лиганд, как, например, это обнаружено для липопротеинов низкой плотности, фактора роста эпидермиса, инсулина и других макромолекул. Показано, что низкое значение рН в эндоцитозных везикулах индуцирует конформационные изменения в гликопротеидах мембран у многих мембраносодержащих вирусов животных, попадающих в цитоплазму путем эндоцитоза. Это облегчает слияние мембраны вируса, в частности вируса гриппа, с мембраной эндосомы и проникновение вирусного генома в цитоплазму.
Плазматическая мембрана
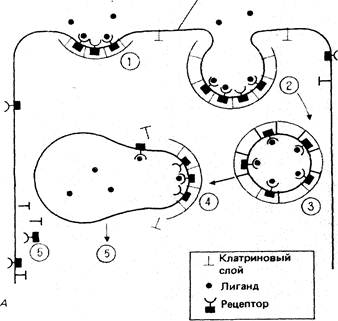
Рис.10. Опосредованный рецепторами эндоцитоз
Использование меченных лигандов показало, что в одной и той же окаймленной ямке может собираться огромное количество рецепторов разных видов. В дальнейшем все комплексы рецепторов с лигандами попадают в одну и ту же эндосому, однако последующая судьба рецепторов и лигандов после их поглощения клеткой может быть различной.
В одних случаях рецептор возвращается обратно в мембрану, а лиганд разрушается. При этом везикулы, несущие пустые рецепторы, сливаются со своими плазматическими мембранами, т.е. вступают в новый эндоцитозный цикл. Лиганд же после диссоциации комплекса с рецептором направляется в лизосомы и там деградирует. Примером такого пути превращений могут служить плазменные липопротеины низкой плотности – ЛПНП. В эндосоме рецептор диссоциирует от своего лиганда (ЛПНП) и через транспортные пузырьки, отщепляющиеся от эндосомы, возвращается в плазматическую мембрану для повторного использования, в то время как лиганд попадает в лизосому. В лизосоме эфиры холестерина, входящие в состав липопротеиновых частиц, гидролизуются до свободного холестерина, который затем используется клеткой при образовании новых мембран.
При втором пути эндоцитоза, характерном для рецепторов фактора роста эпидермиса и инсулина, рецептор, как и лиганд переносится в лизосомы, где они оба деградируют.
Иногда рецептор остается связанным с лигандом и в таком виде возвращается к плазматической мембране. Примером такого пути является эндоцитоз трансферрина – белка, транспортирующего в крови железо. Рецептор связывается с трансферрином, содержащим два атома железа, и переносится в эндосомы, где происходит отделение железа, а апотрансферрин (трансферрин, лишенный железа) вместе с рецептором возвращается в плазматическую мембрану. На поверхности клетки апотрансферрин отделяется от рецептора и снова связывает ионы железа.
Некоторые рецепторы переносят связанные с ними лиганды сквозь клетку в другой домен плазматической мембраны. Это явление, свойственное главным образом рецепторам иммуноглобулинов эпителиальных полярных клеток, получило название трансцитоза. Например, комплекс рецептор-антитело, образующийся на мембране апикальной стороны клетки, через эндосому переносится на базолатеральный домен плазматической мембраны. Здесь этот комплекс, благодаря изменению рН, диссоциирует и антитела попадают в кровеносное русло. Причем рецепторы для IgA и IgM подвергаются протеолитическому расщеплению, тогда как рецептор к IgG при некоторых условиях может использоваться повторно.
Экзоцитозным называется путь, с помощью которого осуществляется транспорт веществ, секретируемых клеткой или включаемых в плазматическую мембрану. Особо важную роль этот процесс играет в функционировании эндокринной и нервной систем. Здесь путем экзоцитоза во внеклеточную среду выходят вещества, служащие сигнальными молекулами для других клеток. Клетками желез внутренней секреции выделяются гормоны, а синаптическими окончаниями нейронов в синаптическую щель высвобождаются медиаторы. Фибробластами соединительной ткани секретируются коллаген и глюкозаминогликаны, включающиеся затем во внеклеточный матрикс. В некоторых случаях имеет место не освобождение синтезированных в клетке веществ во внешнюю среду, а их внедрение в плазматическую мембрану собственных клеток. Таким образом благодаря экзоцитозу происходит включение в плазматическую мембрану клеток рецепторов для антигенов.
Вещества, транспортируемые путем экзоцитоза, последовательно перемещаются из эндоплазматического ретикулума, где они синтезируются, через различные компартменты комплекса Гольджи к плазматической мембране и затем выделяются из клетки. Транспорт между различными внутриклеточными компартментами осуществляется с помощью везикул, которые отпочковываются от "донорной" мембраны и сливаются затем с "акцепторной" (рис.11).
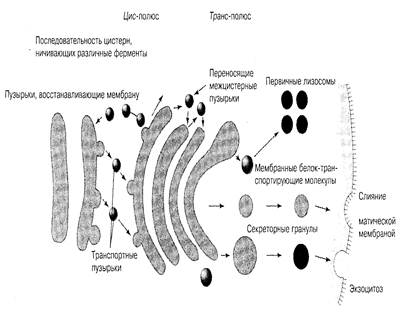
ЭПС Комплекс Гольджи Плазматическая
мембрана
Рис.11. Схема перемещения везикул от ЭПС к плазматической мембране
Везикулы, участвующие в экзоцитозном цикле являются "окаймленными", но соответствующий белок отличается от клатрина, покрывающего эндоцитозные везикулы.
В процесс внутриклеточного передвижения везикул вовлечены элементы цитоскелета, выполняющие роль своеобразных рельсов, вдоль которых движутся везикулы. Для обеспечения их движения необходима энергия, источником которой является АТФ, а также ионы кальция, регулирующие перемещение везикул вдоль микротрубочек.
При встраивании мембраны экзоцитозного пузырька в плазматическую мембрану происходит перераспределение компонентов субмембранного опорно-двигательного аппарата и сокращение микрофиламентов. В экзоцитозной секреции нейромедиаторов из нервной клетки и гормонов из эндокринных желез непосредственное участие принимают ионы кальция. Мембрана регулирует экзоцитозную активность путем регуляции уровня внутриклеточного Са2+. Увеличение направленного внутрь клетки потока Са2+ сопровождается параллельным возрастанием скорости экзоцитозной секреции. Считается, что в присутствии кальция облегчается слияние везикул с плазматической мембраной. Са2+ нейтрализует отрицательный заряд, создаваемый анионными фосфолипидами, и усиливает тем самым агрегацию везикул. Кроме того, кальций способен образовывать мостики между отрицательно заряженными фосфолипидами в близлежащих бислоях, что приводит к выталкиванию воды из пространства между противоположными мембранами и их слиянию.
Существует два основных типа выведения веществ из клетки. Первый тип – стимулируемая секреция – осуществляется в ответ на стимул. Сигнал к началу экзоцитоза может подаваться с помощью гормона, который, связываясь с рецепторами плазматической мембраны, при участии ионов кальция индуцирует экзоцитоз. Второй механизм – конститутивная секреция – представляет собой непрерывный процесс выведения веществ, интенсивность которого регулируется в небольших пределах.
Помимо функции секреции различных макромолекул во внешнюю среду или на поверхность мембраны, экзоцитозу принадлежит большая роль в восстановлении плазматической мембраны. В ходе эндоцитоза, как известно, часть мембранного материала "изымается" из плазматической мембраны на образование внутриклеточных везикул. При экзоцитозе мембраны везикул постоянно сливаются с плазматической мембраной, и в итоге площадь поверхности мембраны сохраняется. Так происходит непрерывное рециклирование мембран: участки плазматической мембраны отшнуровываются от нее с образованием везикул, а внутриклеточные везикулы в свою очередь повторно с той же скоростью включаются в плазматическую мембрану, восстанавливая ее. Следовательно, эндоцитоз и экзоцитоз обеспечивают не только транспорт веществ, но и процессы обмена, обновления и круговорота клеточных мембран.
Как при эндоцитозе, так и при экзоцитозе происходит слияние отдельных мембранных структур, характеризующееся высокой скоростью и избирательностью. Предполагается, что слияние всех мембран в клетках катализируется специальными белками слияния. В клетках такие белки пока не идентифицированы, но в качестве модели рассмотрено поведение белков шиповатых выростов мембраносодержащих вирусов, играющих ключевую роль в проникновении внутрь инфицируемой вирусом клетки. Показано, что при низком рН в белке слияния индуцируются конформационные превращения, приводящие в экспонированию гидрофобной области белка на ее поверхность, что позволяет связаться с липидным бислоем мембраны-мишени. При этом два липидных бислоя контактирующих мембран с помощью таких гидрофобных областей белка слияния приводятся в соприкосновение и они сливаются. Таким образом, для осуществления процесса слияния мембран необходимо, чтобы они вступили в тесный контакт, что достигается путем дегидратации полярных групп липидов. Во-вторых, в плотно прилегающих бислоях должен существовать локальный дефект упаковки, чтобы могли реализоваться межмембранные гидрофобные взаимодействия. На каждом из этих этапов могут принимать участие белки.
Суммируя сказанное, следует напомнить, что мембранный транспорт – это важнейшая функция всех живых клеток, которая осуществляется различными способами. Многие мелкие незаряженные молекулы свободно проходят через липидный бислой. В переносе водорастворимых молекул участвует большое количество транспортных белков, каждый из которых ответствен за транспорт через мембрану определенного вещества. Они либо формируют каналы, образующие в липидном бислое сквозные транспортные пути, либо выполняют роль специфических переносчиков. Одни из таких белков-переносчиков транспортируют вещества без затрат энергии, другие, гидролизуя АТФ, работают как насосы, переносящие ионы и молекулы против концентрационного или электрохимического градиента.
Механизмы проникновения в клетку и выведения из нее макромолекул существенно отличаются от механизмов, опосредующих транспорт небольших молекул и ионов. Они включают в себя процессы последовательного образования и слияния окруженных мембраной пузырьков, обеспечивая питание клеток, секрецию, а также внутриклеточную сортировку синтезированных белков и липидов. Кроме того, направленный перенос мембранного материала от одних клеточных компартментов к другим, играет большую роль в восстановлении и обновлении мембран.
| <== предыдущая страница | | | следующая страница ==> |
| Оборудование тактовой сетевой синхронизации | | | Часть 3. Рецепторная функция мембран |
Дата добавления: 2014-10-02; просмотров: 1709; Нарушение авторских прав

Мы поможем в написании ваших работ!