
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Задача 3. Определить часовой расход натурального и условного топлив, если известны параметры вырабатываемого котельной установкой пара Рпп = 4МПа и t1= 4400С
|
Читайте также: |
Определить часовой расход натурального и условного топлив, если известны параметры вырабатываемого котельной установкой пара Рпп = 4МПа и t1= 4400С, производительность котлоагрегата В = 75 т/ч, потери теплоты с уходящими газами q2 = 6,4%, температура питательной воды tпп= 1500С, Топливо – Донецкий уголь Г(газовый) : CP = 55,2%, HP =3,8%, Sрл= 3,5%, Nр = 1%, OP = 5,8%, АР = 23%, WP = 8%.
Решение:
Низшая рабочая теплота сгорания топлива QHP:
QHP = 339*Cp + 1025*Hp - 108,5*(Оp - Sp) - 25* Wp =
= 338*55,2 + 1025*3,8 - 108,5*(5,8 - 3,5) - 25* 8 = 22103 кДж/кг.
Выбираем способ сжигания и тип топки.
Для сжигания твёрдого топлива выбираем шахтно-мельничную топку. Коэффициент расхода воздуха αт = 1,25. Потери тепла от химической неполноты сгорания q3 = 0,5%; от механической неполноты сгорания q4 = 4%; тепловое напряжение объёма топки qv = 150 кВт/м3.
Теоретически необходимое количество воздуха для полного сгорания 1 кг угля.
V0 = 0,089CP + 0,226HP + 0,033(SP - OP) = 0,089*55,2 + 0,226*3,8 + +0,033*(3,5 – 5,8) = 5,7 м3/кг.
Действительный расход воздуха:
VД = α*V0 = 1,25*5,7 = 7,13 м3/кг.
Объём продуктов сгорания:
VГ = VСГ + VН2О,
где VСГ – объём сухих газов,
VСГ = VRO2 + VRO + VO2,
Объём двухатомных газов:
V0 N2 = 0,79 V0 + 0,8 NP/100 = 0,79*5,7 + 0,8*1/100 = 4,511 м3/кг.
Объём трёхатомных газов:
VRO2 = VСO2 +VSO2 = 0,0187(CP+0,375SP)=0,0187*(55,2+0,375*3,5)=1,06 м3/кг.
Объём сухих газов:
V0СГ = VRO2 + V0 N2 = 1,06 + 4,511 = 5,571 м3/кг.
Объём водяных паров:
V0 Н2О = 0,0124(9НР + Wр )+ 0,0161 V0 = 0,0124*(9*3,8 + 8 )+
+0,0161*5,7 = 0,6151 м3/кг.
Теоретический объём продуктов сгорания:
V0 Г = V0 СГ + V0 Н2О = 5,571 + 0,6151 = 6,1861 м3/кг.
Действительный объём продуктов сгорания:
VСГ = V0СГ + (α – 1) V0 = 5,571 + (1,25 – 1)*5,7 = 6,996 м3/кг.
VН2О = V0Н2О + 0,0161(α – 1) V0 =0,6151 + 0,0161*(1,25 – 1)*5,7 = 0,638 м3/кг.
VГ = 6,996 + 0,638 = 7,634 м3/кг.
Масса продуктов сгорания:
МГ = 1 – 0,01*АР + 1,306*α*V0 = 1 – 0,01*23 + 1,306*1,25*5,7 = 10,08 кг/кг.
Энтальпия продуктов сгорания:
JГ =J0Г+(α – 1)*J0В =VRO2(сυ)CO2+V0N2(сυ)N2+V0H2O(сυ)H2O+(α – 1)* V0(сυ)B ,
где (сυ)i – энтальпия – го компонента, кДж/м3 [4].
При 1500 0С:
JГ(15000C)= 1,06*3504+4,511*2164+0,6151*2779+(1,25-1)*5,7*2239=1838
кДж/м3;
При 2000 0С:
JГ(20000C) =1,06*4843+4,511*2964+0,6151*3926+(1,25 – 1)*5,7*3064 = 3129 кДж/м3.
Строим график JГ = f(t).
При помощи полученного графика определяем температуру горения топлива.
Т = Q pн / (СГ* VГ), так как Т * СГ = JГ ,
то получаем JГ=Q pн / VГ = 22103/7,634 = 2895 кДж/м3.
| JГ, кДж/м3. |
| Т,0С |
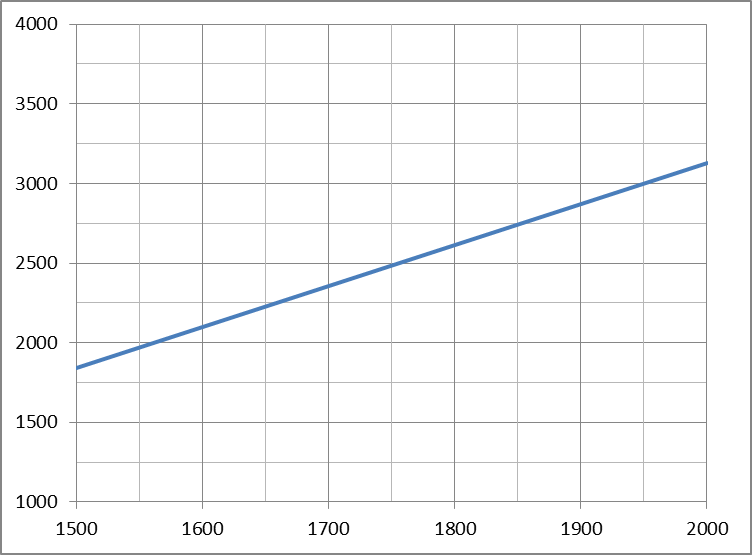
Зависимость энтальпии дымовых газов от температуры.
КПД котлоагрегата.
Уравнение теплового баланса котельного агрегата на 1 кг твёрдого топлива:
Qpp = Q1 + Q2 + Q3 + Q4 + Q5
или в процентах от располагаемой теплоты топлива:
q1 + q2 + q3 + q4 + q5 = 100%,
где Qpp – располагаемая теплота топлива;
Q1 – теплота, полезно использованная в котельном агрегате на получение пара;
Q2 – потери тепла с уходящими газами;
Q3 – потери тепла от химической неполноты сгорания;
Q4 - потери тепла от механической неполноты сгорания;
Q5 – потери тепла на наружное охлаждение.
Qpp = Qнр = 22103кДж/м3.
q2 = 6,4%;
q3 = 0,5%;
q4 =4;
q5 =0,75% (при В = 75 т/ч).
КПД котлоагрегата (брутто).
ηкаБР = q1 = 100 – (q2 + q3 + q4 + q5) = 100 – 6,4 – 0,5 – 4 – 9,75 = 79,35%.
Расход топлива.
D = B*(hпп – hпв)/( Qpp* ηкаБР) = 13,9*(3250 – 628,5)/(22103*0,7935) = 2,08 кг/с = 7488 кг/ч.
hпп = 3250 кДж/кг – энтальпия перегретого пара при Рпп =4 МПа и tпп = 4400С (определяем по h-s-диаграмме);
hпв = 628,5 кДж/кг – энтальпия питательной воды при tпп= 1500С
Расход условного топлива.
Dусл = D* Qнp/ 29350 =2,08*22103/29350 =1,57 кг/с = 5652 кг/ч.
Дата добавления: 2014-10-14; просмотров: 834; Нарушение авторских прав

Мы поможем в написании ваших работ!