
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры решения типовых задач 6 страница
Решение.Резкое снижение концентрации продукта реакции приводит к нарушению равновесия. В соответствии с принципом Ле-Шателье система стремится восполнить возникший дефицит концентрации эфира путем протекания процесса слева направо до нового состояния равновесия. Обозначим количество дополнительно образующегося эфира в результате вновь установившегося равновесия через х. Тогда новый состав равновесной смеси в соответствии со стехиометрией реакции будет выглядеть следующим образом:
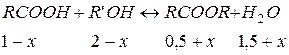
Константа равновесия в соответствии с результатами ранее установившегося равновесия
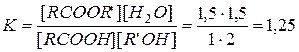 .
.
Новое состояние равновесия характеризуется той же константой
 , откуда
, откуда

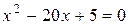 .
.
Это уравнение имеет два решения
 ;
; 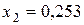 .
.
Первое, как не имеющее физического смысла, отбрасываем и принимаем 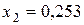 . Новому состоянию равновесия соответствуют следующие концентрации компонентов
. Новому состоянию равновесия соответствуют следующие концентрации компонентов
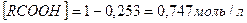
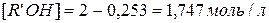
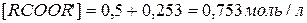
 .
.
Пример 8. Влияние изменения температуры, давления и концентрации на смещение химического равновесия .
Задача 1. Реакция синтеза метанола протекает по уравнению 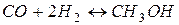 ,
,  .
.
Как надо изменить температуру, давление и концентрацию, чтобы сместить равновесие в сторону образования метанола.
Решение.А) Поскольку реакция экзотермическая, то на повышение температуры (нагревание) система в соответствии с принципом Ле-Шателье реагирует развитием процесса, который ослабляет это воздействие. Это процесс поглощения тепла, т.е. реакция, обратная синтезу метанола. Таким образом, при повышении температуры равновесие смещается в сторону исходных реагентов. Соответственно, чтобы сместить равновесие в сторону образования метанола, температуру необходимо понижать.
Б) На увеличение объема система в соответствии с принципом Ле-Шателье стремится ослабить это воздействие, принимая меньший объем. Поскольку уменьшение объема соответствует протеканию реакции в сторону образования метанола, то с повышением давления равновесие смещается в правую сторону. Поэтому для смещения равновесия в сторону образования метанола давление необходимо повышать.
В) Применение избытка одного из реагентов является фактором смещения равновесия в сторону образования метанола. Благодаря избытку реагента создается его сверхравновесная концентрация, и реакция протекает в направлении, обеспечивающем снижение этой концентрации, т.е. в сторону образования метанола.
1.6. Растворы
Растворы - это гомогенные системы переменного состава, состоящие из двух или более компонентов. Любой раствор состоит из растворённого вещества и растворителя.
Растворитель - это компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы растворителем является вода, а глюкоза - растворённое вещество.
Способы выражения концентрации растворов
Концентрация является важной характеристикой раствора: она определяет относительное содержание компонентов в растворе.
Используются различные способы выражения концентрации растворов.
Молярная концентрация - это количество вещества, содержащееся в одном литре раствора (моль/л):
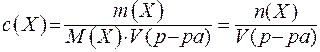
 ,
,
где: 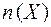 - количество вещества Х (моль);
- количество вещества Х (моль);
V(р-ра) - объём раствора (л).
Молярная концентрация эквивалента (нормальная концентрация) - это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
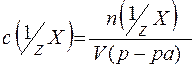 ,
,
где: 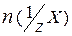 - количество вещества эквивалентов (моль);
- количество вещества эквивалентов (моль);
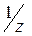 - фактор эквивалентности;
- фактор эквивалентности;
V(р-ра) - объём раствора (л).
Моляльная концентрация - это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
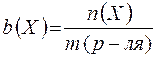 ,
,
где: 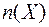 - количество вещества Х (моль);
- количество вещества Х (моль);
m (р-ля) - масса растворителя (кг).
Массовая доля равна отношению массы растворённого вещества к массе раствора (безразмерная величина):
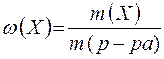 ,
,
где: т (Х) - масса растворенного вещества (г);
т (р-ра) - масса раствора (г).
Молярная доля равна отношению количества растворённого вещества к общему количеству веществ в растворе (безразмерная величина):
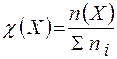 ,
,
где: п (Х) - количество растворенного вещества (моль);
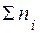 - общее количество вещества всех компонентов раствора.
- общее количество вещества всех компонентов раствора.
1.6.1. Ионно-молекулярные (ионные) реакции обмена
Все многообразие химических превращений можно подразделить на реакции, протекающие без изменения степени окисления атомов элементов, входящих в состав реагентов и продуктов, и реакции, сопровождающиеся изменением степени окисления атомов элементов, входящих в состав реагентов и продуктов – окислительно-восстановительные реакции.
Реакции без изменения степени окисления атомов элементов наиболее часто протекают с участием ионов в растворах, поскольку исходными реагентами таких реакций являются электролиты.
Обменные ионно-молекулярные реакции с участием электролитов представляют собой процессы замещения одного иона другим одноименным ионом (катионом или анионом) в молекуле электролита. В этих реакциях ионы обладают существенно более высокой реакционной способностью по сравнению с молекулами, и поэтому скорость прямой и обратной реакций зависит от концентрации ионов, фигурирующих в левой и правой частях уравнения. Из сказанного следует, что основным фактором, влияющим на смещение равновесия в реакциях растворов электролитов, является изменение концентрации ионов, и обменные реакции преимущественно протекают в направлении образования из ионов молекулярных соединений: осадков, газов или слабых электролитов, что полностью соответствует принципу Ле-Шателье. Если ионы, фигурирующие в правой части уравнений реакций, объединяются между собой в молекулярные формы, их концентрация резко падает, что обеспечивает смещение равновесия в сторону образования таких ионов.
Ионно-молекулярные или ионные уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты полностью диссоциированы и поэтому записываются в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записываются в молекулярной форме.
Растворимость электролитов в насыщенном растворе определяется произведением растворимости ПР, представляющим собой произведение концентраций ионов (катиона и аниона), находящихся в равновесии с осадком вещества, образуемого этими ионами в степенях, равных стехиометрическим коэффициентам при этих ионах. Так, для осадка  , находящегося в равновесии с ионами
, находящегося в равновесии с ионами 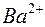 и
и  в растворе
в растворе
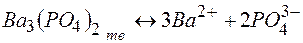
произведение растворимости выражается равенством:
ПР 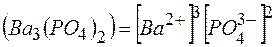 .
.
Зная значение ПР, можно решать вопросы, связанные с образованием или растворением осадков в химических реакциях.
Важным количественным показателем, используемым при анализе ионных реакций, является водородный показатель рН, характеризующий концентрацию ионов водорода в водных растворах
 (1)
(1)
При этом концентрация ионов водорода связана с ионным произведением воды Кw , вытекающим из ее обратимой диссоциации
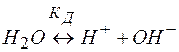 (2)
(2)
Константа диссоциации в соответствии с уравнением (2) определяется как
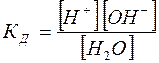 (3)
(3)
Поскольку концентрации [H+] и [OH–]пренебрежимо малы по сравнению с концентрацией воды, последнюю можно считать постоянной. Тогда уравнение (3) можно записать в виде
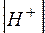
 =
= 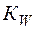 (4)
(4)
где 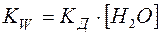
Как всякая константа, КW не зависит от концентрации Н+ и ОН– в растворе. Так, если в воду добавить протонную кислоту, то концентрация ионов Н+ резко возрастет. Тогда равновесие (2) заметно сместится в левую сторону, что приведет к значительному снижению концентрации ионов ОН–, но ионное произведение воды останется неизменным. Таким образом, в водных растворах концентрации Н+ и ОН– в условиях постоянства температуры взаимно связаны между собой: зная концентрацию одного из них, можно определить концентрацию другого, пользуясь выражением (4).
При обычной температуре 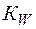 =10–14. Поэтому в нейтральном растворе
=10–14. Поэтому в нейтральном растворе 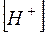 =
=  =
=  0,5=10–7 моль/л и рН в соответствии с выражением (1) равен 7.
0,5=10–7 моль/л и рН в соответствии с выражением (1) равен 7.
В кислой среде  и
и  .
.
В щелочной среде  и
и 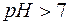 .
.
По аналогии с рН введен показатель рОН:
 (5)
(5)
и показатель  , равный
, равный  . Тогда, логарифмируя уравнение (4), имеем:
. Тогда, логарифмируя уравнение (4), имеем:
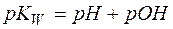 (6)
(6)
Так как  , то
, то  =14, и равенство (6) приводится к виду:
=14, и равенство (6) приводится к виду:
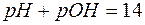 . (7)
. (7)
Уравнения (6) и (7) показывают, что зная рН, можно рассчитать рОН, и наоборот, по известному значению рОН легко определяется рН.
Частным случаем ионных реакций является гидролиз солей – обменное взаимодействие соли с водой, приводящее к образованию слабого электролита. Показателем глубины протекания этой реакции является степень гидролиза, определяемая как отношение концентрации гидролизованных молекул “с” к исходной концентрации растворенных молекул “сO”:
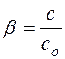 (8)
(8)
Гидролиз является реакцией, обратной нейтрализации, поэтому его результатом является образование пары кислота – основание.
Если объектом гидролиза являются соли сильного основания и сильной кислоты, то такие соли не гидролизуются, так как обратная гидролизу реакция необратима.
Гидролиз соли, образованной слабой кислотой и сильным основанием.
Рассмотрим пример гидролиза ацетата натрия:
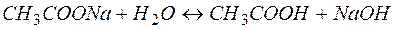 (9)
(9)
В ионной форме уравнение (9) примет вид:
 (10)
(10)
Поскольку результатом гидролиза является образование малодиссоциированного соединения СН3СООН, реакция, выраженная уравнением (9), принимает обратимый характер. Можно видеть, что результатом гидролиза является образование некоторого избыточного количества гидроксид–ионов. Таким образом, при гидролизе соли, образованной сильным основанием и слабой кислотой, среда становится щелочной ( 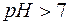 ).
).
В общем виде реакция гидролиза соли сильного основания и слабой кислоты по аналогии с (10) запишется
 (11)
(11)
Константа равновесия гидролиза выражается через равновесные концентрации как
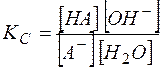 (12)
(12)
Преобразуем это выражение: 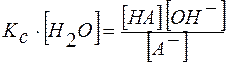 .
.
Так как 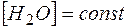 , то ее можно ввести в константу
, то ее можно ввести в константу 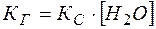 :
:
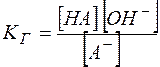 (13)
(13)
Константа  называется константой гидролиза.
называется константой гидролиза.
Умножая числитель и знаменатель правой части уравнения (13) на 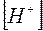 , получим
, получим

Можно видеть, что 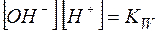 , а отношение
, а отношение  является константой диссоциации слабой кислоты. Таким образом,
является константой диссоциации слабой кислоты. Таким образом,
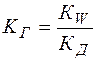 (14)
(14)
В соответствии с уравнением (8)
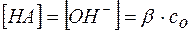 , и
, и 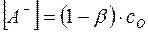 .
.
Подставляя эти значения в уравнение (13), имеем:
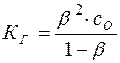 (15)
(15)
или:
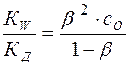 (16)
(16)
Обычно  . Тогда уравнение (15) принимает вид:
. Тогда уравнение (15) принимает вид:
 (17)
(17)
откуда следует, что
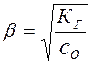 (18)
(18)
Тогда равновесная концентрация гидроксид-аниона составит:
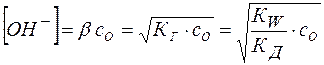 (19)
(19)
и

Отсюда легко рассчитывается рН раствора соли:
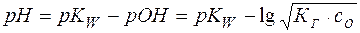 (20)
(20)
Если гидролизу подвергается многоосновный анион, то гидролиз протекает по стадиям:
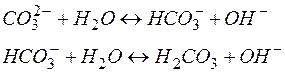
Константа гидролиза по первой ступени (Кг.1 = 2 . 10–4) значительно выше, чем по второй (Кг.2 = 2,2 . 10–8 ), поэтому, при расчете концентраций ионов [Н+] или [ОН–] второй (или третьей) ступенью гидролиза пренебрегают.
Гидролиз соли, образованной сильной кислотой и слабым основанием.
Рассмотрим пример гидролиза хлорида аммония:
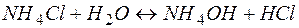
или в ионной форме
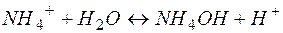
Можно видеть, что результатом гидролиза является образование избыточного количества ионов водорода. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основание, приводит к формированию кислой среды.
Степень гидролиза и константа гидролиза описываются в этом случае теми же уравнениями (8), (13) и (16), но с тем исключением, что в уравнения (13) и (16) входит константа диссоциации слабого основания.
Равновесную концентрацию ионов водорода можно вычислить из уравнения, аналогичного уравнению (19):
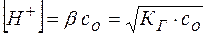 (21)
(21)
Соответственно, водородный показатель среды рассчитывается по уравнению:
 (22)
(22)
Гидролиз соли, образованной слабой кислотой и слабым основанием.
Рассмотрим пример гидролиза подобной соли:

В общем виде эта реакция может быть представлена уравнением:
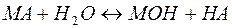 (23)
(23)
Отдельно гидролиз по катиону и по аниону следует уравнениям:


Можно видеть, что в результате гидролиза образуются и катионы водорода, и анионы гидроксида. Нетрудно показать, что константа гидролиза является функцией констант диссоциации продуктов гидролиза – слабого основания (МОН) и слабой кислоты (НА):
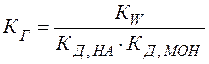 (24)
(24)
Степень гидролиза 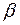 и концентрация
и концентрация 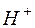 в этом случае не зависят от исходной концентрации соли:
в этом случае не зависят от исходной концентрации соли:
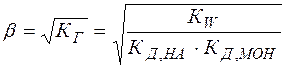 (25)
(25)
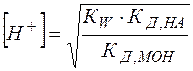 (26)
(26)
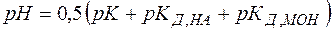 (27)
(27)
Из выражений (26), (27) видно, что в зависимости от соотношения между кислотностью и основностью продуктов гидролиза ( 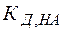 и
и 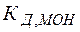 ) среда может приобретать либо кислую, либо щелочную реакцию.
) среда может приобретать либо кислую, либо щелочную реакцию.
Ионно-молекулярные реакции обмена имеют важное значение в аналитической химии, в препаративном неорганическом анализе, а также при получении ряда ценных неорганических соединений. В то же время эти реакции занимают заметное место в процедуре подготовки воды, являющейся важной стадией во многих технологических процессах. Целью этой процедуры является снижение содержащихся в природных водах солей кальция, магния и железа.
1.6.2. ЖЕСТКОСТЬ ПРИРОДНЫХ ВОД И ЕЕ УСТРАНЕНИЕ
Мерой содержания в природных водах солей является жесткость воды. Природная вода, содержащая большое количество растворённых солей кальция, магния и железа, называется жёсткой. Различают общую, временную (карбонатную) и постоянную (некарбонатную) жёсткости.
Общей жёсткостью называется суммарная концентрация ионов Ca2+, Mg2+ и Fe2+ в воде, выраженная в ммоль экв/л. Общая жёсткость воды равна сумме постоянной и временной жёсткости.
Постоянной жёсткостью называется часть общей жёсткости, остающаяся после кипячения воды при атмосферном давлении в течение определённого времени. Постоянную жёсткость воды называют также некарбонатной жёсткостью, т.к. она обусловлена наличием сульфатов, хлоридов, силикатов кальция, магния и железа.
Временной жёсткостью называется часть общей жёсткости, удаляющаяся кипячением воды при атмосферном давлении в течение определённого времени. Она равна разности между общей и постоянной жёсткостью. Временную жёсткость также называют карбонатной жёсткостью, т.к. она обусловлена наличием гидрокарбонатов кальция и магния.
По величине жёсткости воду делят на 6 классов.
| Классы | Жёсткость воды (ммоль экв/л) |
| 1 (очень мягкая) 2 (мягкая) 3 (средней жёсткости) 4 (довольно жёсткая) 5 (жёсткая) 6 (очень жёсткая) | 0 – 1,5 1,5 – 3,0 3,0 – 4,5 4,5 – 6,0 6,0 – 10,0 свыше 10,0 |
Жёсткая вода оказывает вредное действие на технологические процессы и вызывает неприятные явления при использовании её в быту.
Обработка воды, приводящая к снижению жесткости воды, называется умягчением воды.
Существующие способы умягчения можно разделить на 3 группы:
q реагентные (химические) методы умягчения воды. Химическая обработка воды основана на переводе растворимых солей кальция и магния в труднорастворимыее соли; В качестве реагентов–осадителей применяют известь, соду, едкий натр, фосфаты натрия и др. Чаще применяется сода в смеси с известью или едким натром;
q умягчение воды методом ионного обмена (пропускание воды через ионообменные смолы);
q термическое умягчение воды (кипячение).
Для устранения временной жёсткости воды применяют:
– термическое умягчение (кипячение):
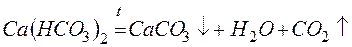
– реагентное умягчение гашёной известью:
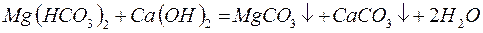

Известь нейтрализует углекислоту, которая является одной из причин коррозии металлов, осаждает железо и способствует коагуляции коллоидов, например, кремниевой кислоты.
Для устранения общей жёсткости методом осаждения используют:
– карбонат натрия (соду):
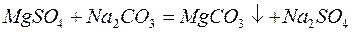

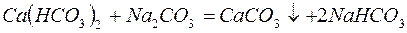
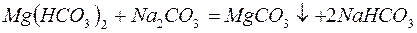
– фосфат натрия (тринатрийфосфат):

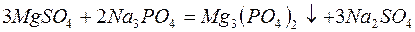
В последнее время для очистки воды стали широко применять иониты (ионообменные смолы). Метод ионного обмена – катионирование основан на фильтровании через слой катионита, при котором происходит замещение ионов Ca2 и Mg2+, содержащихся в воде, на катионы Na+, K+ или NH+4, содержащиеся в твёрдой фазе катионита. В качестве катионитов в основном применяют иониты КУ-I и КУ-2.
В некоторых случаях требуется удалить из воды не только катионы Ca2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н+-катионит) и анионит, содержащий гидроксильные ионы (ОН––анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется обессоливанием:
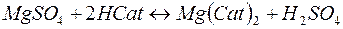
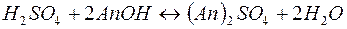
Обменная ёмкость  катионита определяется из соотношения:
катионита определяется из соотношения:
 (ммоль экв/г),
(ммоль экв/г),
где: V- объём воды, пропущенный через катионит, л;
m – масса катионита, г.
Общая жёсткость воды может быть рассчитана по формуле:
 (ммоль экв/л)
(ммоль экв/л)
где: m1, m2, m3 – массы содержащихся в воде катионов кальция, магния (или соответствующих им солей), мг;
Мэкв.1 , Мэкв.2 , Мэкв.3 – молярные массы эквивалентов металлов (или соответствующих им солей), г/моль экв;
V – объём воды, л.
Примеры решения типовых задач.
Пример 1. Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора.
Задача 1. Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты (  =1,18 г/мл) и 200 мл 8% раствора серной кислоты (
=1,18 г/мл) и 200 мл 8% раствора серной кислоты (  =1,05 г/мл).
=1,05 г/мл).
Решение. Рассчитаем массу первого раствора и массу серной кислоты в нем:
m(р-ра)1=  (р-ра)1 .V(р-ра)1=1,18 .200=236 (г);
(р-ра)1 .V(р-ра)1=1,18 .200=236 (г);
m(H2SO4)1 = 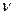 (H2SO4) . M(H2SO4)=c(H2SO4) .V(р-ра)1 .М(H2SO4)=
(H2SO4) . M(H2SO4)=c(H2SO4) .V(р-ра)1 .М(H2SO4)=
=2 .0,2 .98=39,2(г);
Масса второго раствора и масса серной кислоты в нем равны
m(р-ра)2 =  (р-ра)2 .V(р-ра)2 = 1,05 . 200=210 (г);
(р-ра)2 .V(р-ра)2 = 1,05 . 200=210 (г);
m(H2SO4)2 = m(р-ра)2 .  (H2SO4)=210 . 0,08 =16,8 (г).
(H2SO4)=210 . 0,08 =16,8 (г).
Массовую долю полученного раствора рассчитываем по формуле:
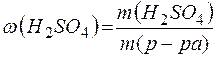 =
= 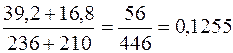 (12,6%)
(12,6%)
Молярная концентрация раствора
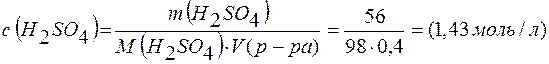 ;
;
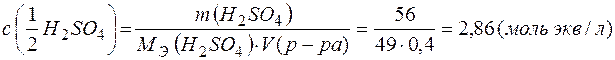
Пример 2. Растворение веществ, взаимодействующих с водой, инахождение концентрации полученного раствора.
| <== предыдущая страница | | | следующая страница ==> |
| Примеры решения типовых задач 5 страница | | | Примеры решения типовых задач 7 страница |
Дата добавления: 2014-10-14; просмотров: 515; Нарушение авторских прав

Мы поможем в написании ваших работ!