
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Первый закон термодинамики. Закон сохранения и превращения энергии
Закон сохранения и превращения энергии.
Согласно учению диалектического материализма - движение неотделимо от материи и является формой ее существования. Мерой движения материи является энергия. Отсюда следует, что различным формам движения материи соответствуют различные виды энергии.
Закон сохранения и превращения энергии гласит:
«Энергия не может быть ни создана, ни уничтожена, а может быть только преобразована из одного вида в другой». Эти преобразования энергии имеют место во всех явлениях природы. Современная наука в значительной мере расширила понятия об энергии, установив взаимосвязь между качественно различными характеристиками материи - энергией и массой тела. В международной системе единиц измерения (СИ) для всех видов энергии принята общая единица измерения – джоуль [1Дж = 1 Нм].
Первый закон термодинамики.
Применительно к термодинамическим процессам в тех случаях, когда энергия подводится или отводится в форме работы и теплоты, закон сохранения и превращения энергии можно сформулировать следующим образом: «Изменение энергии в термодинамическом процессе равно алгебраической сумме всех количеств энергии, полученных или отданных телом в процессе энергообмена».

Рис. 1.8. К выводу аналитического выражения первого закона термодинамики.
Согласно правилу знаков, принятому в термодинамике, положительными считаются подвод теплоты к термодинамической системе и совершение механической работы термодинамической системой (отвод работы), отрицательными - отвод теплоты и совершение работы над термодинамической системой. С учетом этого аналитическое выражение первого закона термодинамики (Закона сохранения и превращения энергии в применении к термодинамическим процессам) записывается следующим образом:
Е2 – Е1 = Q + L,
где Е1- полная анергия термодинамической системы в начальном состоянии;
Е2 - полная анергия термодинамической системы в конечном состоянии.
Если система (тело) не движется (кинетическая энергия системы равна нулю), а потенциальной энергией внешнего поля сил можно пренебречь, то полная энергия системы (тела) будет определяться величиной внутренней энергии тела, то есть E=U.
Тогда первый закон термодинамики запишется в форме U2-U1=ΔU=Q-L и сформулируется следующим образом: «Изменение внутренней энергии рабочего тела в термодинамическом процессе равно разности между энергией, подведенной в форме теплоты и работы». Выражение первого закона термодинамики обычно записывают в виде
Q= ΔU + L
или в дифференциальной форме для 1 кг газа
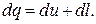
Из этого выражения следует, что в термодинамическом процессе, подведенная к рабочему телу теплота расходуется на изменение внутренней энергии тела - ΔU и на совершение механической работы - L. Математическое выражение первого закона в термодинамике имеет две формы записи.
С учетом выражения для работы газообразного рабочего тела - 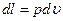 , первая форма записи имеет вид:
, первая форма записи имеет вид:
dq = du + 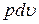 .
.
С учетом понятия энтальпии можно получить вторую форму записи первого закона термодинамики 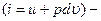
dl = d(u+ 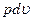 ) = du +d(
) = du +d( 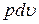 ) = du +
) = du + 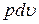 +
+ 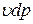 ,
,
откуда получаем du+ 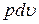 = di -
= di - 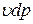 или
или
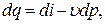
где 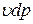 - элементарная располагаемая работа газа в термодинамическом процессе.
- элементарная располагаемая работа газа в термодинамическом процессе.
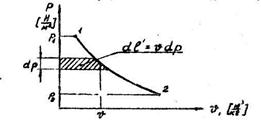
Рис. 1.9. К понятию располагаемой работы в термодинамическом процессе.
Располагаемая работа газа втермодинамическом процессе определяется по выражению:
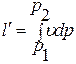 .
.
| <== предыдущая страница | | | следующая страница ==> |
| Аналитические выражения для работы и теплоты в процессе Теплоемкость | | | Второй закон термодинамики. Первый закон термодинамики устанавливает количественные отношения в процессах взаимного превращения энергии |
Дата добавления: 2014-10-28; просмотров: 470; Нарушение авторских прав

Мы поможем в написании ваших работ!