
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Методика проведения работы. Цель работы – исследование эффективности защиты сталей от коррозии в нейтральном электролите с помощью протекторов (Мg
Цель работы – исследование эффективности защиты сталей от коррозии в нейтральном электролите с помощью протекторов (Мg, Аl, Zn), определить радиус их действия и дать качественную характеристику работы протекторов в зависимости от электропроводности электролита (коррозионной среды).
Исследования проводят в растворах, указанных в таблице 1.1, удельную электропроводность электролитов берут из таблицы 1.2.
Растворы приготавливают следующим образом. Необходимое количество хлористого натрия взвешивают на технических весах с точностью до грамма и высыпают в ёмкость на 500 мл. Затем в неё вливают 350 мл дистиллированной воды и перемешивают до полного растворения. В полученный электролит добавляют 3,5 мл 10%-ного раствора красной кровяной соли и перемешивают.
Образцом служит стальной стержень диаметром 7 – 8 мм, длиной 25 см, к одному концу которого на винте прикреплён цилиндр такого же диаметра, длиной 1 см – из цинка, алюминия или магния.
Стальной образец, защищаемый протектором, зачищают наждачной бумагой (вдоль образца), промывают в проточной воде со щеткой и вытирают фильтровальной бумагой. Помещают стальной стержень с прикрепленным к нему протектором в ванну на стеклянные подставки (рисунок 1.1).
Через воронку, доходящую до дна, в ванну наливают раствор.
Через 5-10 минут при помощи масштабной линейки определяют
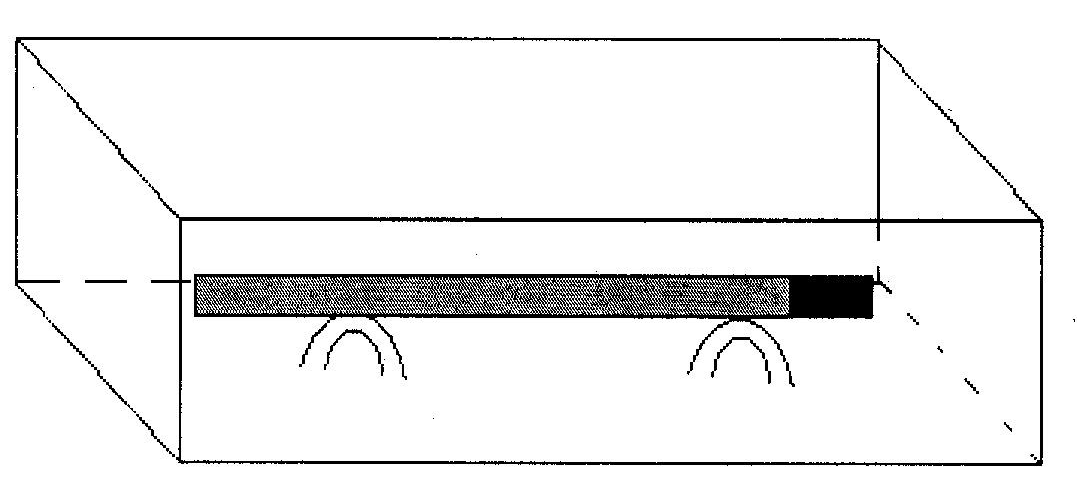
Рисунок 1.1 Образец с протектором, помещенный в ванну
расстояние от места прикрепления протектора до первого синего пятна на стальном стержне. Результаты измерения записывают в таблицу 1.1.
Таблица 1.1 Состав электролита для выполнения работы
| №/№ | Состав электролита | Радиус действия протектора r, см | ||
| Протектор Mg | Протектор Zn | Протектор Аl | ||
| Н2О+10% К3[Fe(СN)6] | ||||
| 0,1%NаСl+Н2О +10%К3[Fe(СN)6] | ||||
| 0,5%NаСl+Н2О +10%К3[Fe(СN)6] | ||||
| 1,0%NаСl+Н2О +10%К3[Fe(СN)6] | ||||
| 1,5%NаСl+Н2О +10%К3[Fe(СN)6] |
Появление этого пятна указывает на образование турнбулевой сини при реакции красной кровяной соли с ионами железа Fe2+, образующимися на незащищенных участках поверхности стержня. Вылив раствор №1, вынимают образец и готовят его так же, как описано выше, для следующего опыта. Ванну и подставки ополаскивают водопроводной водой.
Радиус действия протектора в растворе №2 и в других растворах определят так же, как в растворе №1.
По окончании определения радиуса действия цинкового протектора берут стержень с прикрепленным протектором из алюминия и устанавливают аналогичным образом влияние электропроводности раствора на радиус действия алюминиевого, а затем и магниевого протекторов.
Результаты представляют в виде заполненной таблицы 1.1 и кривых, выражающих зависимость расстояния от протектора до появления пятен турнбулевой сини от удельной электропроводности раствора. На основании полученных данных делают выводы.
Таблица 1.2. Удельная электропроводность водных растворов при 25оС
| Раствор | Химическая формула | Удельная электропроводность, Ом-1см-1, при концентрации | ||
| 1,0 н. | 0,5 н. | 0,1 н. | ||
| Соляная кислота | НСl | 0,300 | 0,180 | 0,0380 |
| Серная кислота | Н2SO4 | 0,170 | 0,100 | 0,0250 |
| Едкое кали | КОН | 0,200 | 0,100 | 0,0220 |
| Едкий натр | NаОН | 0,172 | 0,100 | 0,0108 |
| Хлористый калий | КСl | 0,110 | 0,059 | 0,0128 |
| Хлористый натрий | NаСl | 0,083 | 0,045 | 0,0108 |
| Хлористый аммоний | NН4Сl | 0,107 | 0,057 | 0,0128 |
Вопросы для самопроверки
1. Назовите условия, при которых при которых выполняется максимальная эффективность использования анодных протекторов.
2. Приведите примеры использования анодных протекторов.
3. В чём заключается отличие в использовании катодных и анодных протекторов?
Работа 2
Электрохимическое никелирование стали
Одним из методов защиты металлических изделий от коррозии являются металлопокрытия, полученные электролитическим способом. Электролитический метод осаждения металлов осуществляется путём пропускания постоянного электрического тока через электролит, содержащий ионы осаждаемого металла. При этом на катоде (электроде, соединённым с отрицательным полюсом источника тока) выделяется металлический осадок. Анодами являются пластины осаждаемого металла (растворимые аноды), графит или металл, нерастворимый в электролите (нерастворимые аноды). При электролизе с растворимыми анодами металл анода растворяется, а из раствора на катоде выделяется такое же количество металла, поэтому концентрация ионов осаждённого металла в электролите практически не изменяется в течение электролиза. При использовании нерастворимых анодов постоянство концентрации электролита поддерживается периодическим введением требуемого количества соответствующей соли.
По характеру защитного действия металлические покрытия подразделяются на анодные и катодные. Катодными являются такие покрытия, при которых покрывающий металл имеет более положительный электродный потенциал в данной среде, чем защищаемое изделие.
Анодными покрытиями являются такие покрытия при которых покрывающий металл имеет в данной среде более отрицательный электродный потенциал, чем защищаемый металл, например, покрытие стали цинком. Анодное покрытие будет защищать основной металл, само подвергаясь разрушению.
Как у анодных, так и у катодных покрытий с увеличением толщины слоя уменьшается пористость, поэтому толщина слоя является весьма важной характеристикой покрытия. Пористость покрытия зависит от качества подготовки поверхности защищаемого изделия перед покрытием и условий электролиза. Находящиеся на поверхности образца жиры, оксиды, а также взвешенные частицы в электролите увеличивают пористость покрытия. Чем больше газовыделение на образцах в процессе нанесения покрытия, тем больше пор в покрытии.
Масса металла, выделившегося при электролизе строго подчиняется закону Фарадея, то есть масса вещества Δ mтеор., выделившегося при электролизе, прямо пропорциональна электрическому заряду (количеству электричества), прошедшему через раствор:
Δ mтеор= Кэ·I ∙τ, (2.1)
где Кэ- электрохимический эквивалент, г/(А·ч);
I – сила тока, А;
τ – время электролиза, ч.
Кэ = М/(n·F),(2.2)
где М – молярная масса осаждаемого металла, г/моль;
n – число электронов, участвующих в катодной реакции;
F – число Фарадея, равное 26,8 А·ч/моль.
Выход металла по току η характеризует долю полезно израсходованного количества электричества и определяется как отношение массы практически выделившегося металла Δmпрактк массе теоретически выделившегося металла mтеор:
η = Δmпракт/mтеор.(2.3)
Толщину слоя δ металла, осаждённого на изделие, определяют по формуле:
δ = Δmпракт10-4/(S·ρ), (2.4)
где δ – толщина покрытия, мкм;
Δmпракт – масса практически выделившегося металла, г;
S – площадь покрываемого изделия, см2;
ρ – плотность осаждаемого металла, г/см3.
Гальванические покрытия можно наносить на изделие толщиной от нескольких микрометров до нескольких миллиметров. Покрытия обладают высокой чистотой, равномерно распределены по всей защищаемой поверхности.
Гальванический способ нанесения покрытия по сравнению с другими методами отличается легкостью регулирования толщины покрытия, малым расходом металла, равномерностью покрытия.
| <== предыдущая страница | | | следующая страница ==> |
| МЕТАЛЛОВЕДЕНИЕ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ | | | Методика проведения работы. Цель работы – изучение влияния параметров электролиза на образование антикоррозионного никелевого покрытия на стальной поверхности |
Дата добавления: 2014-11-01; просмотров: 343; Нарушение авторских прав

Мы поможем в написании ваших работ!