
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Основные понятия. Химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света, совершением механической или электрической работы. Энергетические эффекты химических реакций изучает химическая термодинамика.В курсе химии рассмотрим только некоторые положения химической термодинамики.
Объектами изучения химической термодинамики являются разнообразные системы. Система– мысленно или реально выделенная часть пространства, содержащая одно или несколько веществ. Фаза – часть системы, одинаковая по физическим и химическим свойствам во всех точках и отделенная от других частей системы поверхностью раздела.
Для описания систем применяют сложный математический аппарат, в котором используют набор термодинамических функций, основные из которых: 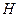 – энтальпия,
– энтальпия, 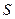 – энтропия,
– энтропия, 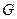 – энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
– энергия Гиббса. В пределах данного курса будем приводить значения функций только для стандартных условий.
· Стандартные условияозначают, что все участвующие в реакции вещества чистые, парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, равно 1,013 · 105 Па, концентрации частиц для реакций в растворах равны 1 моль/л, температура - 298 К. Термодинамические величины, определённые для стандартных условий, обозначают нулём в верхнем правом углу (например, S0).
| <== предыдущая страница | | | следующая страница ==> |
| Свойства солей | | | Закон Гесса. Следствие закона Гесса |
Дата добавления: 2014-02-27; просмотров: 329; Нарушение авторских прав

Мы поможем в написании ваших работ!