
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Закон Гесса. Следствие закона Гесса
Энтальпии образования простых веществ приняты за ноль.
Энтальпии химических реакций
Большинство химических реакций сопровождаются выделением или поглощением тепла.
· Количество тепла, которое выделяется или поглощается в результате химической реакции, называют её тепловым эффектом. Раздел химии, в котором изучают тепловые эффекты химических реакций, называют термохимией.
В дальнейшем тепловые эффекты химических реакций будем характеризовать величиной DH (кДж/моль). Особенности терминологии таковы, что величину DH называют энтальпией химической реакции (вместо более точного словосочетания – изменение энтальпии в ходе химической реакции).
Реакции, идущие с выделением тепла, называют экзотермическими, идущие с поглощением тепла – эндотермическими.
· Принято, что энтальпия экзотермической реакции отрицательна (DH<0), а энтальпия эндотермической реакции положительна (DH>0).
Уравнения химических реакций, записанные с указанием значения энтальпии реакции и агрегатного состояния участвующих в реакции веществ, называют термохимическими уравнениями.Агрегатные состояния веществ обозначают подстрочными индексами: т – твёрдое, к – кристаллическое, ж – жидкое, г – газообразное, р – раствор. В термохимических уравнениях могут быть дробные коэффициенты:
Н2 (Г) + 1/2О2 (Г) = Н2О(Ж) DН0 = – 286 кДж/моль.
В справочных таблицах термодинамических величин приводят не энтальпии конкретных реакций, а стандартные энтальпии образования веществ (DНобр).
· Энтальпией образования называют энтальпию реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных условиях.
Закон, сформулированный Германом Ивановичем Гессом в 1840 году (закон Гесса), – основной закон термохимии:
· энтальпия химической реакции зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий, т.е. от пути процесса.
Из закона Гесса следует, что термохимические уравнения можно складывать и вычитать так же, как и алгебраические.
Следствие закона Гесса:
· энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
Как правило, оперируют со стандартными величинами, т.е.
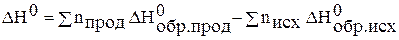 ,
,
где 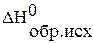 ,
, 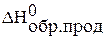 – стандартные энтальпии образования исходных веществ и продуктов реакции;
– стандартные энтальпии образования исходных веществ и продуктов реакции; 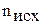 ,
, 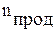 - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии (DS), энергии Гиббса (DG).
| <== предыдущая страница | | | следующая страница ==> |
| Основные понятия. Химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света | | | Энтропия |
Дата добавления: 2014-02-27; просмотров: 547; Нарушение авторских прав

Мы поможем в написании ваших работ!