
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ТЕРМОДИНАМИКИ
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ХИМИЧЕСКОЙ
ПРЕДМЕТ И ЗАДАЧИ ТЕРМОДИНАМИКИ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика возникла в конце первой половины 19 века. В тот период цель термодинамики сводилась к установлению взаимосвязи между теплотой и работой и разработке теории паровой машины. В дальнейшем цели термодинамики расширяются и основные ее положения используются в различных областях, в том числе и химии.
Термодинамика базируется на трех законах, из которых все остальные положения данной науки можно получить путем логических рассуждений.
Первый закон термодинамики связан с законом сохранения энергии и позволяет рассчитывать тепловые балансы процессов.
Второй закон термодинамики - закон о возможности протекания самопроизвольных процессов.
Третий закон термодинамики - закон об абсолютном значении энтропии.
Та часть термодинамики, которая имеет дело с применением этих законов к химическим процессам и фазовым переходам называется химической термодинамикой.
Химическая термодинамика разрабатывает наиболее рациональные методы расчета тепловых эффектов химических процессов, раскрывает закономерности при равновесии, определяет благоприятные условия для осуществления химического процесса.
СИСТЕМА - тело или группа тел, мысленно выделенная из окружающей среды.
ОТКРЫТАЯ СИСТЕМА - система, которая может обмениваться с окружающей средой энергией и веществом.
ЗАКРЫТАЯ СИСТЕМА - отсутствует обмен веществом с окружающей средой, но она может обмениваться энергией с ней.
ИЗОЛИРОВАННАЯ СИСТЕМА - система, объем которой остается постоянным и которая не обменивается энергией и веществом с окружающей средой.
Система может быть гомогенной или гетерогенной.
Совокупность всех физических и химических свойств системы называется
состоянием системы. Свойства, которые могут быть выражены через функции температуры, давления и концентрации веществ называются термодинамическими. Для полного описания системы достаточно знать некоторое наименьшее число термодинамических свойств, которые рассматривают как внутренние параметры системы (параметры состояния системы).
Обычно в качестве параметров состояния системы выбирают такие ее свойства, которые наиболее легко определить экспериментальным путем, например давление (Р),объем (V),температура (Т) и концентрация (Сi)компонентов.
Параметры состояния системы связаны между собой соотношением, которое называется уравнением состояния. В общем виде f(P,V,T) = 0
PV = n RT
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС - изменение во времени хотя бы одного из термодинамических свойств.
САМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ - процессы, не требующие затраты энергии извне.
НЕСАМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ -процессы, требующие затраты энергии.
РАВНОВЕСНОЕ СОСТОЯНИЕ - состояние системы, которое сохраняется неизменным во времени.
ПОСТУЛАТ - Протекание самопроизвольного процесса в конечном счете приводит систему в равновесное состояние.
ВНУТРЕННЯЯ ЭНЕРГИЯ - совокупность всех видов энергии частиц в системе. Обозначается U. Является функцией состояния, т.е. ее изменение не зависит от того как идет процесс, а будет определяться только исходным и конечным состояниями системы.
РАБОТА ПРОЦЕССА - форма передачи энергии от изучаемой системы к окружаюшей среде или от окружающей среды к системе путем преодоления сил, действующих на систему со стороны окружающих тел или в противоположном направлении. Обозначается W(A). Работа, совершаемая системой, принимается положительной, а работа окружающей среды отрицательной. Полная работа (W) рассматривается как сумма работ изменения объема системы и всех других видов работ, связанных с преодолением сил, действующих на систему, называемых полезной работой (Wп). Работа определяется соотношением
W = 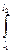 F dl
F dl
Если действующая сила вызвана внешним давлением (F = PS ), где S - площадь, к которой приложено давление, то работа преодоления внешнего давления
W = 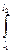 P S dl =
P S dl =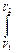 P dV
P dV
Полная работа
W = 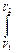 P dV + Wп
P dV + Wп
ТЕПЛОТА ПРОЦЕССА (Q) - форма передачи энергии от изучаемой системы к окружающей среде путем микрофизических процессов (столкновений молекул).Теплота считается положительной, когда она подводится к системе.
| <== предыдущая страница | | | следующая страница ==> |
| ИСТОРИЧЕСКИЙ ОЧЕРК РАЗВИТИЯ ФИЗИЧЕСКОЙ ХИМИИ | | | ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ |
Дата добавления: 2014-03-11; просмотров: 473; Нарушение авторских прав

Мы поможем в написании ваших работ!