
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
Топливные элементы
В последнее время снова возрос интерес к топливным элементам, идея создания которых возникла еще в конце прошлого века. Их основное преимущество перед остальными ХИТ заключается в следующем: здесь электрохимически активные вещества не закладываются в ограниченном количестве в электроды, как в других элементах, а подводятся извне по мере расходования. Запас активных материалов (топливо и окислители) может быть поэтому как угодно велик, теоретически топливный элемент способен разряжаться неограниченно долгое время. Пока ресурс 2000-5000 часов.
Другое преимущество топливного элемента - возможность использовать в качестве активных веществ газы и жидкости, энергетически более выгодные, чем твердые вещества. Чаще других используют водород, метиловый спирт, гидразин, а также кислород и перекись водорода.
Работы в области водородно-кислородного элемента оказались наиболее результативными. Несмотря на многие технические трудности, этот элемент раньше других удалось довести до промышленного образца. В водородно-кислородно топливном элементе:
С/графит/,Н2 ½NaOH ½ 02,С/ графит/;
водород барботирует через один, а кислород - через другой пористый угольный электрод, оба электрода погружены в водный растворе едкого натра. В элементе протекают следующие реакции:
2Н2 + 4 ОН- = 4 Н20 + 4е;
О2 + 2Н2О + 4е = 4ОН- ;
2Н2 + О2 = 2Н2О.
Такие элементы дают 60-70% максимально полезной работы. Если же сжечь Н2 и О2 для получения теплоты газовой турбины, то получается совсем незначительное количество работы вследствие низкого кпд теплового двигателя.
Тот факт, что единственным продуктом электродных реакций является
вода, представляет дополнительный интерес при использовании элементов в таких автономно действующих аппаратах, как батискаф, подводная лодка, космический корабль.
Космические корабли «Аполлон» были оснащены топливными элементами. За время 13 космических полетов, в том числе 7 лунных, электрохимические генераторы выработали 4,37 тыс. кВт-час электроэнергии и 1400 кг воды. Батареи продемонстрировали высокую степень надежности и позволили выполнить программу “Аполлон” (не считая взрыва на Аполлоне 13).
Коррозия металлов определяется как процесс самопроизвольного разрушения металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой.
Корродируют обычно металлы, встречающиеся в природе не в самородном состоянии, а как соответствующие минералы и руды. На извлечение этих металлов из руд или минералов расходуется известное количество энергии. В результате коррозионного разрушения они снова переходят в окислы, сульфиды, карбонаты и другие природные соединения. Процесс коррозии, так как он приводит к регенерации исходных соединений, термодинамически более устойчивых по сравнению с чистыми металлами, протекает с уменьшением свободной энергии и поэтому совершается самопроизвольно.
Отсюда разрушение многих металлов проходит со значительной скоростью и
приносит колоссальный ущерб всем отраслям народного хозяйства. Ежегодно от 5 до 20% выплавляемого количества черных металлов разрушается в результате коррозии.
Различают химическую, биохимическую и электрохимическую коррозию металлов. Химическая - самопроизвольное разрушение металлов под действием химических реагентов. Биокоррозия вызывается жизнедеятельностью различных микроорганизмов, использующих металл как питательную среду, или выделяющие продукты, действующие разрушающее на металл. Электрохимическая коррозия - разрушение металлов при протекании нескольких сопряженных электрохимических реакций, скорость которых зависит от величины электродного потенциала. Электрохимическая коррозия происходит при воздействии на металлы влажной атмосферы, разнообразных электролитов, почвенной влаги.
В зависимости от характера разрушений, сопровождающих процесс электрохимической коррозии, различают сплошную коррозию, захватывающую всю поверхность металла, и местную, локализующуюся на определенных участках. Очаги разрушения в случае местной коррозией могут иметь вид пятен (пятнистая коррозия) или точек (питтинговая коррозия). Они могут захватывать отдельные зерна (избирательная коррозия), проходить через зерна в виде узких трещин (транскристаллитная коррозия) и др.
Скорость коррозии выражают несколькими способами. Наиболее часто пользуются весовым и токовым показателем коррозии. Первый из них дает потерю веса (в г или кг) за единицу времени (с, час, год), отнесенную к единице площади (см2, м2) испытуемого образца. Во втором случае скорость коррозии выражается силой тока ( А или мА), приходящейся на единицу площади образца.
Электрохимическая коррозия металлов возникает, если наряду с анодным растворением металла:
Ме = Меz+ + ze,
возможны условия для катодного процесса в другой окислительно-восстановительной системе с более положительным потенциалом, например, в системе Н+/Н2 :
Н+ + е = Н2 ;
О2 + 2Н2О + 4е = 4ОН- .
Следует различать коррозию идеально чистого металла и технического металла. Для идеально чистого металла скорость коррозии определяется перенапряжением и скоростью выделения водорода на этом же металле.
При рассмотрении коррозии технического металла процесс коррозии усложняется, так как поверхность технического металла неоднородна и содержит включения других, в том числе и более электроположительных металлов с меньшим перенапряжением водорода.
Например, в техническом цинке имеются включения кристаллов железа. Неоднородную поверхность технического металла на границе с электролитом можно рассматривать как совокупность локальных короткозамкнутых электрохимических элементов. В данном примере Zn -отрицательный полюс такого элемента - на нем металл электрохимически растворяется. Положительный полюс микроэлемента - железо, на нем выделяется водород. Суммарная скорость растворения Zn будет определяться кинетикой выделения водорода на основном металле и включениях постороннего металла. Присутствие локальных микроэлементов приводит к тому, что коррозия технических металлов оказывается во много раз больше коррозии чистых металлов.
Скорость коррозии, возникающей в результате работы локальных гальванических пар, зависит не только от электрохимических свойств электродов этих пар, но и от омического сопротивления среды, в которой совершается процесс коррозии и которая отделяет анод от катода.
Определяющие скорость коррозии соотношения удобнее выразить графически при помощи коррозионных диаграмм Эванса:
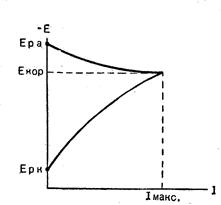
Когда нет коррозионного процесса и сила тока равна нулю, начальные значения потенциалов на аноде и катоде должны отвечать обратимым потенциалам анодной и катодной реакции. За счет разности потенциалов анода и катода в системе появляется ток. При некоторой силе тока потенциал анода сместится вследствие поляризации в сторону более положительных, а потенциал катода - в сторону более отрицательных значений. С увеличением силы тока разность потенциалов анода и катода будет непрерывно сокращаться. В пределе она будет равна нулю, когда сопротивление системы равняется нулю или ничтожно мало. Ток при этом будет максимальным.
Таким образом, скорость коррозии является функцией разности обратимых потенциалов анодной и катодной реакции, их поляризуемости и омического сопротивления коррозионной среды.
| <== предыдущая страница | | | следующая страница ==> |
| Характеристика важнейших гальванических элементов | | | Метода защиты металлов от коррозии |
Дата добавления: 2014-03-11; просмотров: 444; Нарушение авторских прав

Мы поможем в написании ваших работ!