
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Определение дихроматной (бихроматной) окисляемости воды методом потенциометрии
Окисляемость – это величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей. Выражается этот параметр в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 дм3 воды. Окисляемость – комплексный параметр, позволяющий оценить общее загрязнение воды органическими веществами.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – «химическое потребление кислорода»). ХПК – это количество окислителя (или эквивалентное ему количество кислорода), израсходованное на окисление содержащихся в воде примесей.
Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость (а значит и более «богаты» органикой) по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2–3 мг О2/дм3, реки равнинные – 5–12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3. Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфянников, в сильно заболоченных местностях).
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, бихроматная окисляемость (ХПК) используется в качестве меры содержания органического вещества в пробе воды. Таким образом, ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О2/дм3.
1 Метод измерений
Метод основан на регистрации значения потенциала при титровании раствором соли Мора избытка дихромата калия после окисления им загрязнителей сточной воды.
2 Средства измерений
Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 210 г;
Бюретка вместимостью 25 см3;
Иономер И–130 М или рН-метр рН–150 М;
Пипетка Мора вместимостью 10 и 20 см3;
Цилинды мерные вместимостью 50 и 100 см3;
Электрохимическая ячейка, включающая индикаторный (платиновый) и электрод сравнения (хлоридсеребряный).
3 Вспомогательные материалы
Бумага масштабная координатная;
Колба круглодонная вместимостью 250 см3;
Мешалка магнитная;
Стаканы химические вместимостью 200 см3;
Холодильник обратный;
Шарики стеклянные.
4 Материалы, реактивы и растворы
Вода дистиллированная;
Калия дихромат (K2Cr2O7), раствор – 0,25 моль/дм3;
Квасцы железоаммонийные (FeNH4(SO4)2H2О), раствор – 0,25 моль/дм3;
Кислота серная (H2SO4), концентрированная;
Ртути сульфат (HgSO4), ч.д.а.;
Серебра сульфат (Ag2SO4), ч.д.а.
5 Подготовка к выполнению измерений
5.1 Подготовка средств измерений
Иономер и электроды готовят к работе в соответствии с инструкциями по эксплуатации (Приложение Е). рН-метр готовят к работе в соответствии с Приложением Ж.
5.2 Подготовка пробы
Пробу анализируемой воды – 20 см3 – помещают в круглодоную колбу, добавляют 10 см3 раствора дихромата калия и по 0,4 г сульфатов ртути и серебра (для катализации окисления органических соединений).
Раствор перемешивают, добавляют 30 см3 серной кислоты и вводят стеклянные шарики для обеспечения равномерного кипения. К колбе присоединяют обратный холодильник и кипятят 2 ч, смесь охлаждают, отсоединяют холодильник и добавляют 100 см3 дистиллированной воды.
Аналогичным образом осуществляют подготовку контрольной пробы с 20 см3 дистиллированной воды.
6 Порядок выполнения измерений
Содержимое колбы (с анализируемой водой) (по п. 5.2) перемешивают, переносят в стакан, погружают электроды, якорь магнитной мешалки и титруют избыток дихромата калия раствором железоаммонийных квасцов при постоянном перемешивании.
После каждой порции титранта регистрируют значение потенциала. Титрование заканчивают зарегистрировав значение потенциала в трех точках после его резкого изменения.
По аналогичной методике анализируют контрольную пробу.
7 Обработка и вычисление результатов измерений
7.1 Построение кривых потенциометрического титрования и определение КТТ
По полученным данным (см. п. 6) строят графики в координатах 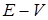 и
и 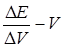 . По графикам находят КТТ и объем титранта, израсходованный на титрование.
. По графикам находят КТТ и объем титранта, израсходованный на титрование.
7.2 Расчет дихроматной окисляемости
Дихроматную (бихроматную) окисляемость (ХПК, мг/дм3) вычисляют по формуле:
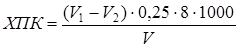 ,
,
где V1 и V2 – объемы раствора железоаммонийных квасцов, израсходованные на титрование контрольной пробы и анализируемого раствора соответственно, см3; 0,25 – концентрация раствора железоаммонийных квасцов, моль/дм3; 8 – 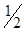 молярной массы кислорода, г/моль; 1000 – коэффициент пересчета, учитывающий переход от г к мг; V – объем пробы воды, взятой для анализа, см3.
молярной массы кислорода, г/моль; 1000 – коэффициент пересчета, учитывающий переход от г к мг; V – объем пробы воды, взятой для анализа, см3.
Результаты вычислений округляют до двух значащих цифр после запятой. За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до одного знака после запятой.
8 Индивидуальное задание
Определить ХПК в образцах природной воды и на основании полученного результата определить их происхождение.
7.10 Лабораторная работа № 10
| <== предыдущая страница | | | следующая страница ==> |
| Обработка и вычисление результатов измерений | | | Определение витамина С во фруктах, ягодах и продуктах их переработки методом потенциометрии |
Дата добавления: 2014-07-19; просмотров: 621; Нарушение авторских прав

Мы поможем в написании ваших работ!