
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Уравнение изотермы химической реакции. Константа химического равновесия
Все химические реакции в той или иной мере обратимы, т.е. наряду с прямой реакцией (взаимодействием исходных веществ) протекает и обратная реакция (взаимодействие продуктов реакции). По мере расходования исходных веществ скорость прямой реакции уменьшается, а скорость обратной - возрастает. Когда обе скорости сравняются, наступает состояние динамического равновесия: концентрации всех веществ, участвующих в реакции (исходных веществ и продуктов), перестанут изменяться во времени при неизменных внешних условиях. Такое состояние называется химическим равновесием.
Химическое равновесие подвижно. Изменение внешних условий, например температуры, сдвигает равновесие в ту или иную сторону, т.е. оно устанавливается уже при других равновесных концентрациях реагентов. При этом бесконечно малое изменение внешних условий вызывает бесконечно малое смещение равновесия. То есть химические реакции вблизи состояний равновесия могут протекать как термодинамически равновесные процессы и к ним можно применять общие условия термодинамического равновесия.
Получим выражение для изменения изобарного потенциала при протекании реакции:

 aA+bB dD+eE (3.1)
aA+bB dD+eE (3.1)
при постоянных Р и Т. Применим к данной реакции уравнение (2.69):
dGP,T= 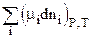 ,
,
где mi - химический потенциал компонента; ni - число молей компонента.
Для реакции (3.1) уравнение (2.69) примет вид:
dGP,T=mEdnE+mDdnD -mAdnA -mBdnB (3.2)
Вещества реагируют пропорционально стехиометрическим коэффициентам а,b,d,e. Количество реагирующего вещества dni, отнесенное к его стехиометрическому коэффициенту в уравнении реакции ni, характеризует полноту протекания реакции и называется химической переменной - x (дзета):
dx= dni/ni (3.3)
С учетом (3.3) уравнение (2.69):
dGP,T = S[(ni mi)dx]P,T (3.4)
Для одного пробега реакции химическая переменная x изменяется от 0 до 1. Поэтому интегрирование уравнения (3.4) от исходного до конечного состояния приведет к выражению:
DGP,T=S(ni mi)прод - S(ni mi)исх (3.5)
или конкретно для химической реакции (3.1):
DGP,T = emE + dmD - amA - bmB (3.6)
Допустим, все реагенты - идеальные газы с начальными относительныминеравновесными парциальными давлениями компонентов 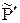 A,
A, 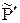 B,
B, 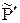 D,
D, 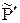 E . Подставив в уравнение (3.6) значения химических потенциалов компонентов идеальной газовой смеси (2.78):
E . Подставив в уравнение (3.6) значения химических потенциалов компонентов идеальной газовой смеси (2.78):
mi=m0i+RT ln 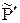 i ,
i ,
получим:
DGP,T = (em0E+dm0D-am0A-bm0B) + RT ln 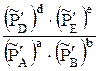 (3.7)
(3.7)
Следует заметить, что в уравнении (3.7) и далее под знаком логарифма стоят безразмерные, относительные парциальные давления компонентов (см. параграф 2.9). В состоянии химического равновесия DGP,T=0, а давления всех компонентов становятся равновесными 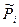 (без штриха). Тогда из уравнения (3.7) в условиях равновесия получим:
(без штриха). Тогда из уравнения (3.7) в условиях равновесия получим:
em0E + dm0D - am0A- bm0B = -RT ln 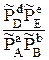 (3.8)
(3.8)
Левая часть уравнения (3.8) в условиях постоянства P и T представляет собой константу, Δμº реакции. Следовательно, и в правой части выражение под знаком логарифма является величиной постоянной в указанных условиях. Обозначим ее 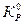 :
:
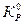 =
= 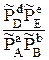 (3.9)
(3.9)
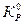 называется стандартной константой химического равновесия. При термодинамических расчетах часто используется эмпирическая константа равновесия КР, выраженная через абсолютные значения парциальных давлений:
называется стандартной константой химического равновесия. При термодинамических расчетах часто используется эмпирическая константа равновесия КР, выраженная через абсолютные значения парциальных давлений:
КР = 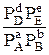 (3.10)
(3.10)
Следует помнить, что численное совпадение констант, рассчитанных по уравнениям (3.9) и (3.10) возможно только в двух случаях: когда за стандартные парциальные давления компонентов принимаются давления равные 1 атм и тогда численные значения относительных и абсолютных парциальных давлений одинаковы, или, если Δν реакции [см. уравнение (3.22)] равно нулю. В общем случае они связаны соотношением:
КР = 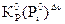 (3.11)
(3.11)
Уравнения (3.9) и (3.10) выражают закон действующих масс. Этот закон был впервые количественно сформулирован Гульдбергом и Вааге (1867 г).
Константа химического равновесия, выраженная через парциальные давления компонентов (КР и 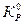 ) - зависит только от температуры. Она не зависит от механизма, кинетики процесса, от общего давления в системе и начальных парциальных давлений компонентов. Однако, это не означает, что химический состав при равновесии не будет изменяться с давлением. Ниже это влияние будет рассмотрено при описании других способов выражения константы равновесия (КN, KC).
) - зависит только от температуры. Она не зависит от механизма, кинетики процесса, от общего давления в системе и начальных парциальных давлений компонентов. Однако, это не означает, что химический состав при равновесии не будет изменяться с давлением. Ниже это влияние будет рассмотрено при описании других способов выражения константы равновесия (КN, KC).
С учетом принятого обозначения (3.9) и уравнения (3.8), из уравнения (3.7) получим:
DGP,T = - RT ln 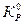 + RT ln
+ RT ln 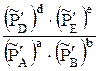 (3.12)
(3.12)
Уравнение (3.12) называется уравнением изотермы химической реакции Вант-Гоффа.
Уравнение (3.12) можно записать в виде:
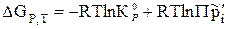 , (3.13)
, (3.13)
где
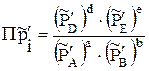 (3.14)
(3.14)
При стандартных условиях, т.е. если 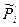 =1, то
=1, то 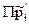 =1, тогда из (3.13):
=1, тогда из (3.13):
DG0P,T = - RT ln 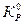 (3.15)
(3.15)
Уравнение (3.15) называется уравнениемстандартной изотермы, а DG0P,T - стандартным изобарным потенциалом реакции.
Константа химического равновесия - важнейшая характеристика реакции. Ее можно определить экспериментально по данным химического анализа или рассчитать теоретически по уравнению:
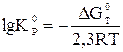 (3.16)
(3.16)
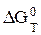 реакции рассчитывается по уравнению:
реакции рассчитывается по уравнению:
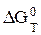 =
= 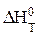 - Т
- Т 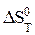 , (3.17)
, (3.17)
где 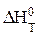 - стандартный тепловой эффект реакции при температуре Т;
- стандартный тепловой эффект реакции при температуре Т; 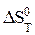 - стандартная энтропия реакции при температуре Т.
- стандартная энтропия реакции при температуре Т.
Тепловой эффект реакции 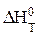 при данной температуре рассчитывают по уравнению Кирхгофа [(1.63) или (1.64)].
при данной температуре рассчитывают по уравнению Кирхгофа [(1.63) или (1.64)].
Изменение энтропии реакции 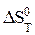 при данной температуре Т рассчитывают по уравнению:
при данной температуре Т рассчитывают по уравнению:
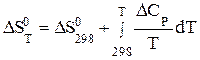 (3.18)
(3.18)
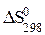 определяют по стандартным значениям абсолютных энтропий продуктов реакции и исходных веществ (уравнение 2.9).
определяют по стандартным значениям абсолютных энтропий продуктов реакции и исходных веществ (уравнение 2.9).
Мы рассмотрели вывод уравнения изотермы для реакции, протекающей в идеальной газовой смеси, выражая константу равновесия через парциальные давления компонентов. Рассмотрим другие способы выражения констант равновесия.
Парциальные давления компонентов Рi связаны с их молярными долями Ni и общим давлением в системе Р соотношением Pi = PNi .
Молярная доля компонента:
Ni = ni/Sni = Pi/P (3.19)
Поскольку для “n” молей компонента i по уравнению КлапейронаМенделеева PiV = niRT, то
Pi = niRT/V = CiRT , (3.20)
где Ci - концентрация компонента в моль/л.
Выразим КР через молярные доли Ni и молярные концентрации компонентов Сi :
КР= 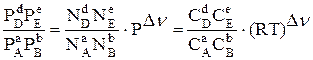 (3.21)
(3.21)
где Dn = S(ni)прод. - S(ni)исх. , (3.22)
νi - стехиометрические коэффициенты в уравнении реакции. Введя в уравнение (3.21) соответствующие обозначения констант равновесия, выраженных через Ni и Ci , получим соотношение констант:
КР = КN×PDn = KC×(RT)Dn (3.23)
Если реакция, протекающая в газовой фазе, не сопровождается изменением числа молей, то Dn=0 и
КР = КN = KC (3.24)
Для реальных газовых систем константу равновесия выражают через летучесть fi и обозначают Кf, а для реакций в реальных растворах - через активность аi компонентов, Ка. В идеальных растворах применяют выражения для КN или KC. При этом следует помнить, что в термодинамических расчетах и в этих случаях применяют стандартные константы равновесия, выражая их через относительные величины соответствующих параметров, как указано выше (см. параграф 2.9).
Большинство реальных газов до давлений порядка 50 атм подчиняются уравнению Клапейрона - Менделеева и к ним правомерно применение в расчетах констант КР, т.е. констант, выраженных через парциальные давления, а не фугитивности.
| <== предыдущая страница | | | следующая страница ==> |
| Химический потенциал. Активность | | | Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна |
Дата добавления: 2014-10-02; просмотров: 609; Нарушение авторских прав

Мы поможем в написании ваших работ!