
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Б. Нарушение процессов перехода жира из крови в ткань
При недостаточной активности липопротеинлипазы крови нарушается переход жирных кислот из хиломикронов (ХМ) плазмы крови в жировые депо (не расщепляются триглицериды). Чаще это наследственное заболевание, обусловленное полным отсутствием активности липопротеинлипазы. Плазма крови при этом имеет молочный цвет в результате чрезвычайно высокого содержания ХМ. Наиболее эффективным лечением этого заболевания является замена природных жиров, содержащих жирные кислоты с 16–18 углеродными атомами, синтетическими, в состав которых входят короткоцепочечные жирные кислоты с 8–10 углеродными атомами. Эти жирные кислоты способны всасываться из кишечника непосредственно в кровь без предварительного образования ХМ.
Гиперлипопротеинемия — повышенное содержание липопротеинов в крови. Различают несколько типов, в зависимости от причины и преобладающих липопротеинов. Так при нарушении липопротеинлипазы (фермент клеточных мембран, необходимый для поступления в клетку триглицеридов из хиломикронов крови) в крови накапливаются хиломикроны и триглицериды. Резкое увеличение в крови ЛПОНП наблюдается при гиперинсулинизме (избытке инсулина), т.к. инсулин стимулирует синтез триглицеридов в печени.
В. Избыточное накопление жира в жировой ткани в результате нарушений депонирования жира
Ожирение – это избыточное накопление триглицеридов в организме. Ожирением считается увеличение массы тела более чем на 20 % от идеальной для данного организма. Образование адипоцитов происходит ещё во внутриутробном состоянии, начиная с последнего триместра беременности, и заканчивается в препубертатный период. После этого жировые клетки могут увеличиваться в размерах при ожирении или уменьшаться при похудании, но их количество не изменяется в течение жизни. Ожирение - важнейший фактор риска развития инфаркта миокарда, инсульта, сахарного диабета, артериальной гипертензии и желчнокаменной болезни.
Первичное ожирение характеризуется множеством гормональных и метаболических особенностей у лиц, страдающих этим заболеванием. В самом общем виде можно сказать, что первичное ожирение развивается в результате алиментарного дисбаланса — избыточной калорийности питания по сравнению с расходами энергии. Количество потребляемой пищи определяется многими факторами, в том числе и химическими регуляторами чувства голода и насыщения. Эти чувства определяются концентрацией в крови глюкозы и гормонов, которые инициируют чувство насыщения: холецистокинина, нейротензина, лептина.
Причины первичного ожирения:
• генетические нарушения (до 80% случаев ожирения — результат генетических нарушений);
• состав и количество потребляемой пищи, метод питания в семье;
• уровень физической активности;
• психологические факторы.
У человека и животных имеется «ген ожирения». Продуктом экспрессии этого гена служит белок лептин, состоящий из 167 аминокислот, который синтезируется и секретируется адипоцитами и взаимодействует с рецепторами гипоталамуса. В результате его действия снижается секреция нейропептида Y. Нейропептид Y стимулирует пищевое поведение, поиск и потребление пищи у животных. Другие пептиды, участвующие в регуляции чувства сытости, например холецистокинин, также влияют на секрецию нейропептида Y. Таким опосредованным путём лептин выступает регулятором жировой массы, необходимой для роста и репродукции.
Следовательно, можно сделать вывод о том, что первичное ожирение - не просто следствие переедания, а результат действия многих факторов, т.е. ожирение - полигенное заболевание.
Вторичное ожирение - ожирение, развивающееся в результате какого-либо основного заболевания, чаще всего эндокринного. Например, к развитию ожирения приводят гипотиреоз, синдром Иценко-Кушинга, гипогонадизм и многие другие заболевания.
Липидоз печени – накопление жировых капель в гепатоцитах, ожирение печени. Связано с нарушением синтеза фосфолипидов и апопротеинов (белковых компонентов липопротеинов крови), в сочетании с избыточным поступлением жирных кислот, глицерина, триглицеридов в печень и с повышением синтеза триглицеридов в печени. Такое состояние может развиваться при активной мобилизации жира при одновременном недостатке метионина и холина. Основной причиной липидоза печени служит нарушение баланса между активностью синтеза триглицеридов в печени и скоростью их включения в структуру ЛПОНП, т.е. недостаточный синтез липопротеинов очень низкой плотности, что может быть связано с нарушением синтеза апопротеинов или с недостаточностью лецитина.
Д. Нарушение промежуточного жирового обмена
Кетоз (кетоацидоз) – накопление в крови и во всем организме кетоновых тел в избыточном количестве. В крови здорового человека кетоновые (ацетоновые) тела содержатся в очень небольших концентрациях. Однако при голодании, а также у лиц с тяжелой формой сахарного диабета содержание кетоновых тел в крови может повышаться до 20 ммоль/л. Это состояние носит название кетонемии; оно обычно сопровождается резким увеличением содержания кетоновых тел в моче (кетонурия). Например, если в норме за сутки с мочой выводится около 40 мг кетоновых тел, то при сахарном диабете содержание их в суточной порции мочи может доходить до 50 г и более. Механизмы, приводящие к увеличению кетоновых тел в крови (кетозу), достаточно сложны:
- Одной из основных причин развития кетоза является дефицит углеводов (например, при сахарном диабете, голодании), который приводит к обеднению печени гликогеном и усиленному поступлению в нее жира, где и происходит окисление жирных кислот до ацетоуксусной кислоты. Этому способствует также недостаточный ресинтез высших жирных кислот из кетоновых тел и нарушение окисления их в трикарбоновом (лимонном) цикле. Для ресинтеза необходима энергия гликолиза. Недостаточное окисление кетоновых тел связано также с дефицитом соединений, образующихся при промежуточном обмене углеводов (пировиноградная и щавелевоуксусная кислоты) и являющихся субстратами цикла трикарбоновых кислот.
- Важным патогенетическим звеном в развитии кетоза при сахарном диабете является одновременная недостаточность липокаина и инсулина.
- При поражении печени, вызванном токсино-инфекционными факторами, нарушена гликогенобразовательная функция печени, что способствует переходу в печень жирных кислот. Здесь образование кетоновых тел в значительной степени превалирует над их окислением. В результате возникает кетоз и жировая инфильтрация печени.
Перекисное окисление липидов – свободнорадикальное окисление липидов, вызванное пероксидным ионом. При изучении процессов биологического окисления рассматривается вариант короткой цепи окисления – перекисное окисление. Кроме полезного действия (например, разрушение мембран фагоцитированных микробов в лейкоцитах) при спонтанном образовании перекиси, образовавшийся пероксидный ион способен вступать в реакцию со многими молекулами. В белках окисляются некоторые аминокислоты, активные формы кислорода легко нарушают и структуру ДНК. Перекисное окисление липидов – это цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления. В клетке присутствует довольно развитая система защиты от перекисного окисления (антиоксидантная система), включающая ферменты, нейтрализующие перекиси и свободные радикалы (каталаза, глютатионредуктаза) и молекулы «ловушки» свободных радикалов и активных ионов (мембранная система витамина Е и селена, глютатион, аскорбиновая кислота). Наиболее развита антиоксидантная система в клетках, больше подверженных окислению, где выше парциальное давление кислорода, например, эритроциты, лейкоциты, эпителиальные клетки дыхательных путей. При несостоятельности антиоксидантной системы перекисное повреждение липидов приводит к повреждению мембранных структур клетки, что нарушает функционирование клетки и является основным механизмом ее гибели.
Нарушение метаболизма фосфолипидов, как правило, вторично, связано с перекисным повреждением, либо с нарушением обмена отдельных аминокислот (метионина, таурина, серина). В качестве самостоятельной патологии не рассматривается, приводит к нарушению печени (липидоз), нарушению транспорта липидов в организме (гиполипидемии, или выпадение триглицеридов в осадок на стенках сосудов), снижению растворимости холестерина желчи и нарушение реологических (увеличение вязкости) свойств желчи (появление «пыли» и желчных камней). Все эти состояния могут быть связаны с недостаточностью полиненасыщенных жирных кислот, которые входят в состав фосфолипидов.
Известны некоторые наследственно обусловленные патологические состояния, связанные с избыточным отложением в тканях фосфолипидов. Например, при болезни Гоше цереброзиды откладываются в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. При болезни Нимана - Пика в клетках различных органов наблюдается отложение фосфатида сфингомиелина. Амавротическая (от греч. amauros — темный, слепой) идиотия является результатом отложения липоидов в нервных клетках, что сопровождается атрофией зрительных нервов и слабоумием.
Нарушения холестеринового обмена лежат в основе развития атеросклероза, желчнокаменной болезни и других заболеваний. Для медицины человека наибольшее значение имеет атеросклероз.
Атеросклероз– хроническая болезнь артерий, приводящая постепенно к сужению сосудов и нарушению их функции. Это означает, что кровоток по артерии, снабжающей кислородом и питательными веществами интенсивно работающий орган, с появлением в ней атеросклероза становится недостаточным. В результате функциональные возможности органа снижаются, иногда значительно. В пораженных атеросклерозом участках артериальной стенки всегда обнаруживают скопления холестерина наряду с клетками и волокнами рубцовой ткани.
Это давало повод считать холестерин причиной развития атеросклероза. С расширением и углублением научных знаний о природе атеросклероза выяснилось, что это совсем не так. Холестерин в большом количестве вырабатывается и содержится в тканях и органах, как головной мозг, надпочечники, входит в состав оболочек клеток живого организма, чрезвычайно богата им и жировая ткань. В физиологических условиях содержание холестерина в крови взрослого человека составляет около 1,8-2,3 г/л.
В человеческом организме холестерин подвергается различным превращениям. При этом в зависимости от особенностей обмена могут образовываться такие соединения холестерина (главным образом с веществами белковой природы), в составе которых он легче проникает в стенку сосудов. Концентрация холестерина в сыворотке крови оказывается в таких случаях, как правило, повышенной, поэтому наблюдающаяся у большинства больных атеросклерозом избыточная концентрация холестерина в крови считается фактором нежелательным, ускоряющим прогрессирование болезни.
Важная, если не решающая роль в возникновении и дальнейшем развитии атеросклероза принадлежит изменениям клеток тканей артериальной стенки, отклонениям в биохимических процессах, совершающихся в ней. В тех случаях, когда липидные отложения закупоривают сосуды сердца и мозга, развивается соответственно ишемическая болезнь сердца или инсульт, ткань миокарда или мозга гибнет из-за недостатка в них кислорода.
В животных жирах есть два компонента, которые могут способствовать развитию атеросклероза – насыщенные жирные кислоты и холестерин. Большинство животных жиров, в частности жиры мыса, молока и яиц, содержат относительно много насыщенных и мало ненасыщенных жирных кислот, исключение составляют куриный и рыбий жир.
По калорийности ценность насыщенных и ненасыщенных жиров примерно одинакова, однако обильное потребление насыщенных животных жиров с незначительным количеством полиненасыщенных жиров может привести к уменьшению концентрации в крови липопротеидов высокой плотности (ЛПВ) и к увеличению липопротеидов низкой плотности (ЛПНП), а также общего холестерина. Существует корреляция между частотой ишемической болезни сердца, с одной стороны, и низкой концентрацией липопротеинов высокой плотности, и высокой концентрацией липопротеинов низкой плотности, а также общего содержания холестерола – с другой. Поэтому рекомендуется содержащиеся в мясе, яйцах, молоке, сливочном масле и сыре жиры животного происхождения заменять растительными жирами.
В результате нарушения соотношения между этими группами липопротеинов развивается увеличение количества холестерина в организме (при этом абсолютное содержание холестерина в крови может быть не повышено). Холестерин ввиду низкой растворимости выпадает в осадок, накапливается в клетках и в интиме сосудов, что приводит к пролиферации клеток (они пытаются израсходовать избыток холестерина на построение дополнительных мембран). Так формируются холестериновые «бляшки» и холестериноз сосуда (увеличение содержания холестерина в стенке сосуда в клетках) переходит в атеросклероз.
Главной причиной развития атеросклероза является нарушение выведения холестерина из организма и одновременное увеличение его синтеза в гепатоцитах, что обусловлено неправильным восприятием клеткой липопротеинов низкой плотности (генетические или иммунологические нарушения структуры рецепторов к апопротеинам, либо модификация белковых компонентов липопротеинов). В ответ на нарушение этого восприятия в печени усиливается синтез холестерина, что приводит к еще большему накоплению его в организме. Избыток поступления холестерина с пищей и повреждение проницаемости сосудов являются лишь способствующими факторами накопления холестерина и формирования бляшки.
6. Интеграция метаболических путей обмена липидов
Ранее были рассмотрены отдельные метаболические пути, обеспечивающие синтез и расщепление молекул липидов различных классов. В клетке эти метаболические пути взаимодействуют друг с другом, обеспечивая переключение потока вещества с одного метаболического пути на другой в соответствии с потребностями клеток. Кроме того, в любой живой системе обмен липидов связан с обменом соединений других классов, например, обменом углеводов или белков.
Пищевые липиды являются источниками высших жирных кислот, глицерола, аминоспиртов и некоторых других соединений, используемых организмом для синтеза свойственных ему структурных или резервных липидов. Свободные высшие жирные кислоты (ВЖК), наряду с глицеролом и аминоспиртами образуются в организме также при расщеплении резервных или структурных липидов. Еще одним источником ВЖК может служить их синтез из ацетила-КоА, который в свою очередь, может быть промежуточным продуктом обмена углеводов или аминокислот. Жирные кислоты в клетках используются в различных метаболических путях клетки только в их активированной форме - в виде ацил-КоА.
Одним из ключевых метаболитов липидного обмена является ацетил-КоА, так как: во-первых, именно через это соединение осуществляется окислительное расщепление высших жирных кислот; во-вторых, через ацетил-КоА атомы углерода жирных кислот могут быть использованы для пластических целей - для синтеза холестерола или полипреноидов; в-третьих, через ацетил-КоА в гепатоцитах углеродные цепи жирных кислот преобразуются в ацетоновые тела гидрофильные "топливные" молекулы, легко транспортируемые в клетки различных органов и тканей; в-четвертых, через ацетил-КоА осуществляются метаболические превращения углеродных скелетов аминокислот и моносахаридов в жирные кислоты, используемые в дальнейшем для синтеза более сложных липидных молекул.
Взаимосвязь обмена нуклеиновых кислот и липидов (триглицеридов)
Прямая «субстратная» форма связи не характерна для обмена нуклеиновых кислот и липидов. Косвенная взаимосвязь обмена нуклеиновых кислот и липидов проявляется в том, что β-окисление высших жирных кислот – составных частей большинства липидов – служит энергетическим источником для поддержания на достаточном уровне синтеза нуклеозиддифосфатов и нуклеозидтрифосфатов.
Взаимосвязь обмена белков и липидов
Распад липидов, как и распад углеводов, обеспечивает, с одной стороны, исходные соединения для биосинтеза аминокислот (а из них – белков), и, с другой стороны, поддерживает образование белков энергетически, так как при окислении жиров много энергии запасается в связях АТФ.
Одним из основных продуктов распада липидов, в частности высших жирных кислот, возникающих при гидролизе триглицеридов и других липидов, является ацетил-КоА. Включаясь в цикл Кребса, он обеспечивает синтез α-кетоглутаровой кислоты и щавелевоуксусной кислоты, а из последней путем декарбоксилирования - пировиноградной кислоты. Из названных кетокислот синтезируются аминокислоты. Обмен глицерина, высвобождаемого при гидролизе триглицеридов, через углеводы ведет к таким аминокисотам, как гистидин, фенилаланин, тирозин и триптофан. Следовательно, все постоянно встречающиеся в белках аминокислоты могут синтезироваться за счет распадающихся липидов. Возможен также синтез липидов за счет распадающихся белков. Так, при распаде аминокислот образуется пировиноградная кислота (ПВК). При ее окислительном декарбоксилировании возникает ацетил-КоА – исходное соединение для синтеза высших жирных кислот и других составных частей липидов.
Взаимосвязь обмена углеводов и липидов
Связующим звеном при переходе от углеводов к липидам является пировиноградная кислота (ПВК) и ацетил-КоА. ПВК путем окислительного декарбоксилирования превращается в ацетил-КоА, который служит исходным соединением для синтеза в организме высших жирных кислот, триглицеридов и других липидов. 3-Фосфогицериноый альдегид, возникающий при дихотомическом распаде углеводов, изомеризуясь, превращается в фосфодиоксиацетон. При восстановлении последнего образуется фосфоглицерол, необходимый для синтеза простых и сложных липидов. Ацетил-КоА и глицерол – главные продукты распада липидов – служат исходными соединениями для синтеза углеводов. Ацетил-КоА переходит в ПВК, а из нее – в углеводы путем обращения реакции их дихотомического распада. Превращение глицерина в углеводы идет через 3-фосфоглицериновый альдегид, а затем описанным выше способом. Взаимосвязь липидного, углеводного и белкового обмена показана на рис.19.
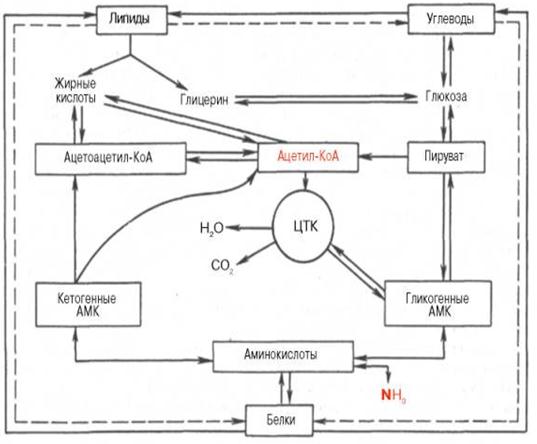
Рис.19. Взаимосвязь липидного, углеводного и белкового обмена
Таким образом, обмен липидов оказывается тесно связанным с обменом соединений других классов, а метаболические пути обмена липидов различных классов являются частью общей метаболической сети, функционирующей в организме.
7. КЛЮЧЕВЫЕ ТЕРМИНЫ И ПОНЯТИЯ К ГЛАВЕ II
Аполипротеины (апопротеины) - низкомолекулярные белки, входящие в состав липопротеинов; обеспечивают растворимость липидного компонента, транспорт различных липидов в ходе их перераспределения между тканями и депонирование в жировой и ряде периферических тканей, образование активных форм ферментов, действующих на липопротеины.
Ацетилкоэнзим А, ацетил-КоА, ацетилкофермент А - продукт конденсации коэнзима А с уксусной кислотой, содержит макроэргическую связь; образуется в реакции окислительного декарбоксилирования пировиноградной кислоты, а также в реакции, катализируемой ацетил-КоА-синтетазой и при β-окислении высших жирных кислот. Участвует в различных обменных реакциях, например в синтезе высших жирных кислот, холестерола, стероидных гормонов, цитрил-КоА, является универсальным донором ацетильных групп для реакций ацетилирования.
Ацетил-КоА-карбоксилаза - полифункциональный фермент, относится к классу лигаз, осуществляет превращение ацетил-КоА в малонил-КоА.
Ацилкоэнзим А, ацил-КоА - продукт конденсации коэнзима А с карбоновой кислотой, содержит макроэргическую связь, образуется в результате действия ацил-КоА-синтетазы, участвует в обменных реакциях в живой клетке.
Ацилпереносящий белок, АПБ - субдомен синтетазы высших жирных кислот, его простетическая группа служит «подвижной рукой», переносящей в правильной последовательности ковалентно связанные остатки высших жирных кислот от одного субдомена синтазы высших жирных кислот к другому.
α-Глицерофосфат, α-фосфоглицерин - сложный эфир глицерина и фосфорной кислоты. Образуется при фосфорилировании глицерина либо при восстановлении диоксиацетонфосфата; является важнейшим промежуточным продуктом обмена липидов и углеводов. В основном используется в биосинтезе триглицеридов и фосфатидов.
β-кетобутирил-КоА (CH3COCH2CO~SKоA) - продукт конденсации двух молекул ацетил-КоА, содержит макроэргическую связь.
Липазы - ферменты класса гидролаз, ускоряющие гидролиз внешних сложноэфирных связей в молекулах триглицеридов. Различают простые Л., катализирующие освобождение высших жирных кислот из свободных триглицеридов, и липопротеинлипазы, гидролизующие связанные с белками липиды. Активность Л. регулируется путем их фосфорилирования — де-фосфорилирования.
Липосомы - искусственно получаемые сферические частицы диаметром менее 10 мкм, образованные из бимолекулярного слоя липидов; применяются в экспериментальных исследованиях как модели биологических мембран, а также в качестве «микроконтейнеров» при создании препаратов биологически активных веществ, предназначенных для «адресной» доставки к определенным органам и тканям.
Малонил-КоА (НООС-СН2-СО~SКоА) - продукт конденсации коэнзима А и малоновой кислоты, содержащий макроэргическую связь. Синтезируется из ацетил-КоА, СО2 за счет энергии АТФ при участии фермента ацетил-КоА-карбоксилазы; является исходным соединением для биосинтеза высших жирных кислот.
α-Окисление высших жирных кислот - окисление по α-углеродному атому высших жирных кислот в присутствии пероксидазы с отщеплением от жирной кислоты по одному атому углерода в виде СО2. Оно не связано с синтезом АТФ, подвергаются ему жирные кислоты с очень длинной цепью (более 20 углеродных атомов), входящие в липиды мозга и других отделов нервной ткани, а также жирные кислоты с разветвленной углеводородной цепью, характерные для растений.
β-Окисление высших жирных кислот - специфический путь распада высших жирных кислот, осуществляемый в результате окисления β-углеродного атома и поэтапного отщепления от молекул двухуглеродных фрагментов в виде ацетил-КоА. Данный процесс происходит в матриксе митохондрий и является источником энергии для синтеза АТФ. Жирные кислоты вступают в реакции β-окисления в активированном состоянии, т. е. в связанном макроэргической связью с коэнзимом А в результате реакции, которую катализирует фермент ацил-КоА-синтетаза.
Синтетаза высших жирных кислот (синтаза ВЖК) - полифункциональный фермент, обеспечивающий многостадийный циклический процесс синтеза высших жирных кислот; последовательно удлиняет радикал жирной кислоты на два углеродных атома, донором которых служит малонил-КоА.
Фосфолипазы - ферменты класса гидролаз подкласса эстераз, катализирующие гидролитический распад фосфатидов.
Холевые кислоты, желчные кислоты - класс органических полициклических кислот, важнейшие ингредиенты желчи млекопитающих. Являются конечными продуктами обмена холестерола. Натриевые соли X. к. — эмульгаторы жиров, способствующие их всасыванию и перевариванию.
Холестеролэстераза - фермент класса гидролаз, катализирует каталитическое расщепление эфиров холестерола.
Цитидиндифосфатхолин, ЦДФ-холин - нуклеотидный кофермент, содержащий в своем составе гетероциклическое основание цитозин, рибозу, два остатка фосфорной кислоты и холин; образуется из фосфохолина и ЦТФ. При биосинтезе лецитина он передает остаток фосфохолина на диглицерид.
| <== предыдущая страница | | | следующая страница ==> |
| А. Нарушение процессов всасывания жиров | | | ГЛАВА 1. СУБЪЕКТЫ (УЧАСТНИКИ) СУДЕБНОЙ ЭКСПЕРТИЗЫ |
Дата добавления: 2014-10-02; просмотров: 777; Нарушение авторских прав

Мы поможем в написании ваших работ!