
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНС ПРОЦЕССОВ ГОРЕНИЯ
4.1. Уравнение материального баланса процессов горения
Сущность материального баланса процесса горения заключается в том, что масса веществ и материалов, присутствующих до горения, должна равняться массе веществ и материалов, получившейся после горения.
В общем виде уравнение материального и теплового баланса выглядит так:
nг [Г] + nо [О] = å mi[ПГ]i + Qх.р.
где [Г] - химическая формула горючего вещества;
[О] - химическая формула окислителя;
[ПГ]i - химическая формула i-го вещества, образовавшегося в результате реакции горения;
nг, nо, mi - стехиометрические коэффициенты при соответствующих веществах;
Qх.р. - тепловой эффект реакции горения.
Это уравнение отражает в большинстве химических процессов лишь исходное и конечное состояние реагирующей системы, но не дает сведений о тех путях и промежуточных фазах, через которые этот процесс осуществлялся. Если окислительной средой будет являться кислород воздуха, то уравнение примет вид:
nг [Г] + nо2 [О2] + nо2 ×3,76[N2] = å mi[ПГ]i + nо2 ×3,76[N2] + Qх.р.
Это уравнение можно использовать для расчета количества воздуха, необходимого для полного сгорания веществ и материалов, количества выделившихся продуктов сгорания веществ и материалов, что необходимо для решения некоторых практических задач противопожарной защиты (например, для определения количества вещества, которое может выгореть до момента самопроизвольного потухания в замкнутом помещении, содержащем заданный объем воздуха, или для определения количества того или иного продукта сгорания, которое может выделиться при сгорании определенного количества горючего вещества).
Для пересчета объема воздуха или газообразных продуктов горения, находящихся при нормальных условиях, в объем для заданных условий используется уравнение:
Vт,р = (VoTPo)/(ToP)
которое получено из уравнения состояния идеальных газов:
(PoVo)/To = (PVт,р)/T
Ро = 101325 Па (760 мм рт.ст.);
То = 273 К (0°С);
Vo = 22,4 м3/кмоль - объем одного кмоля любого газа при нормальных условиях.
4.2. Воздух, необходимый для горения веществ и материалов
Индивидуальные химические вещества
Расчет производится по следующей формуле:
Vво = 4,76×b [м3/м3] или [кмоль/кмоль],
где (4,76 = 1 + 3,76) - это количество воздуха, в котором содержится 1 кмоль О2;
b - отношение количества молекул окислителя к количеству молекул горючего в уравнении реакции горения:
b = no2 / nг
Например, для метана bсн4 = 2/1 = 2.
Уравнение (17.4) в основном используется для газообразных горючих веществ.
Для твердых и жидких горючих веществ применяется уравнение:
Vво = 4,76b×Vо/Мг [м3/кг]
Для заданных условий имеем:
Vвт,р = 4,76b×Vот,р/Мг [м3/кг]
В этом случае предварительно рассчитывается по уравнению состояния идеальных газов объем 1 кмоля газов для заданных условий.
Мг - молярная масса горючего вещества.
Вещество сложного состава
Общий объем воздуха, необходимый для горения единицы массы вещества, будет складываться из объемов воздуха, необходимых для горения каждого из элементов, входящих в состав вещества, за вычетом объема воздуха, соответствующего количеству кислорода, содержащегося в веществе:
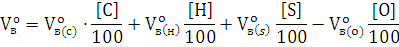
где Vво(с), Vво(н), Vво(s) - количество воздуха, необходимое для горения единицы массы соответствующего элемента (м3/кг);
Vво(о) - количество воздуха, в котором содержится 1 кг кислорода (м3/кг);
C, H, S, O - содержание соответствующего элемента в горючем веществе (% вес.).
Определим значения Vво(с), Vво(н), Vво(s)
С + О2 = СО2
nc = 1; no2 = 1; b(с) = 1;
Vво(с) = (4,76×1×Vo)/12;
Н2 + 0,5О2 = Н2О
nн = 1; no2 = 0,5; b(н) = 0,5;
Vво(н) = (4,76×0,5×Vo)/2;
S + О2 = SО2
ns = 1; no2 = 1; b(s) = 1;
Vво(с) = (4,76×1×Vo)/32.
Находим значение Vво(о) 1 кмоль О2 (32 кг) занимает объем при нормальных условиях Vo. Так как в воздухе на каждый объем кислорода приходится 3,76 объема азота, то 32 кг кислорода будет содержаться в 4,76×Vo м3 воздуха. Тогда Vво(о) = (4,76Vo)/32.
Подставляя полученные значения в уравнение и принимая, что Vo = 22,4 м3/кмоль, получаем:
Vво = 0,267 (С/3 + Н + (S-О)/8) [м3/кг]
Смесь газов
Для расчетов Vво необходимо провести расчеты для каждого газа, входящего в смесь, и полученные результаты сложить. Когда газовая смесь и воздух находятся в одних и тех же условиях, то объем воздуха, необходимый для полного сгорания смеси газов, можно определить по формуле:
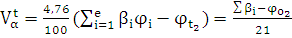 , [м3/м3]
, [м3/м3]
где jо2 - содержание кислорода в газовой смеси (% об.);
ji - содержание i-го компонента в газовой смеси (% об.).
Избыток воздуха
Разность между количеством воздуха, присутствующим при горении, и теоретически необходимым количеством воздуха называется избытком воздуха:
DVво = Vво(пр) - Vво
Отношение количества воздуха, практически участвующего в процессе горения, к теоретически необходимому называется коэффициентом избытка воздуха:
aв = Vво(пр)/Vво
Если известно количество кислорода, которое содержится в продуктах горения после сгорания горючего вещества, aв можно определить следующим образом:
aв = 21/(21-jо2 пг)
где jо2 пг - количество О2, содержащееся в продуктах горения (% об.).
В случае кинетического горения при Vво(пр) = Vво aв = 1. Смесь горючего с воздухом является стехиометрической.
При aв < 1 смесь богатая. Характерной чертой процесса горения является образование продуктов неполного горения.
При aв > 1 смесь бедная. Часть воздуха не расходуется на горение (избыток воздуха) и переходит в продукты горения.
DVво = Vво(пр) - Vво = Vво(aв - 1);
Vво(a) = Vво + DVво
4.3. Объем и состав продуктов горения веществ и материалов
Расчетный объем продуктов горения определяется по формуле:
Vпг = Vпго + DVв
где Vпго - теоретический объем продуктов горения (кмоль/кмоль, м3/кг, м3/м3).
Теоретический объем продуктов горения определяется также для трех групп веществ и материалов.
Индивидуальное химическое соединение
При сгорании 1 кмоля или 1 м3 горючего вещества расчет ведется по формуле:
Vпго = å mi/nг + 3,76nо2 /nг [м3/м3; кмоль/кмоль]
Эта формула чаще используется для газообразных горючих веществ. Для жидких и твердых горючих веществ применяется формула:
Vпго = (å mi/nг + 3,76nо2 /nг)Vо/Мг [м3/кг]
Для расчета объема продуктов горения при заданных условиях используется формула:
Vпгтр = (Vпго×Т×Ро)/(То×Р)
Вещество сложного состава
Сложная смесь химических элементов обычно состоит из C, H, N, S, W, A, O, которые заданы в процентном отношении. Для определения состава, количества и объема продуктов горения 1 кг сложной смеси химических веществ необходимо составить реакции горения каждого элемента (C, H, S) и определить объем продуктов горения. Азот и влага W также переходят в продукты горения. Входящий в горючее вещество кислород будет участвовать в горении, тем самым уменьшая расход воздуха на горение, что в свою очередь будет снижать расчетный объем азота в продуктах горения.
С + О2 + 3,76N2 ® СО2 + 3,76N2;
S + О2 + 3,76N2 ® SО2 + 3,76N2;
Н2 +0,5 О2 + 0,5×3,76N2 ® Н2О + 0,5·3,76N2.
Таким образом, в теоретический объем продуктов горения будут входить:
- СО2 , который образуется при горении С;
- Н2О в виде пара, который образуется при горении Н и испарении W вещества;
- SО2 , который образуется при горении S;
- N2 , который образуется из горючего вещества и переходит в продукты горения из воздуха, расходуемого на горение C, H и S.
Для удобства расчеты сведем в таблицу.
| Компонент горючего | Объем ПГ (м3) на 1 кг компонента | |||
| СО2 | Н2О | SO2 | N2 | |
| C | 22,4/12=1,86 | - | - | 3,76×22,4/12=7 |
| H | - | 22,4/2=11,2 | - | 0,5×3,76×22,4/2=21 |
| S | - | - | 22,4/32=0,7 | 3,76×22,4/32=2,63 |
| W | - | 22,4/18=1,24 | - | - |
| N | - | - | - | 22,4/28=0,8 |
| O | - | - | - | -3,76×22,4/32=-2,63 |
Состав продуктов горения при сгорании 1 кг горючего вещества определяется следующим образом.
Voco2 = 1,86С/100;
Voso2 = 0,7S/100;
Voн2o = 11,2Н/100 + 1,24W/100;
VoN2 = 0,01[7С + 21H + 0,8N + 2,63(S - O)] или
VoN2 = 0,79Vво + 0,8N/100 [м3/кг],
где C, H, S, N, O и W - содержание соответствующих элементов и влаги в горючем веществе (% вес.).
Общее количество продуктов горения будет равно:
Vпго = å Vпго(i) = Vсo2o + Vн2oo + Vso2o + VN2o
Смесь газов
Количество и состав продуктов горения для смеси газов определяется по уравнениям горения каждого газа, входящего в смесь. Негорючие газы переходят в продукты горения, а содержание кислорода в смеси газов снижает количество азота в продуктах горения. Общее количество продуктов горения будет равняться:
Vпго = åVпго(i)j¢(i) [м3/м3; кмоль/кмоль]
где Vпго(i) - объем продуктов горения, выделившихся при сгорании 1м3 и 1кмоль i-го горючего газа, входящего в смесь газов;
j¢(i) - объемные доли i-го газа, входящего в смесь газов.
Состав продуктов горения можно определить по следующим формулам:
Vсо2о = åVсо2о(i)ji¢;
Vн2оо = å Vн2оо(i)ji¢;
Vsо2о = å Vsо2о(i)ji¢;
VN2о = å VN2о(i)ji¢
Дым
В реальных пожарах, наряду с продуктами полного и неполного горения, образуются твердые и жидкие частицы различных веществ (смола, окислы, вода и т.д.).
Дисперсная система, состоящая из мельчайших твердых и жидких частиц (дисперсная фаза), взвешенных в дисперсионной газообразной среде (продуктах горения), называется дымом.
4.4. Тепловой баланс процессов горения
В расчете на единицу количества горючего вещества тепловой баланс зоны горения можно записать так:
Qн + Qисх - Qнедож = Qпг + Qпот
где Qисх - количество тепла, поступающего в зону горения с горючим веществом и окислителем (если aв = 1, Тн = 293 К, Qисх » 0,03Qн);
Qнедож - количество тепла, нереализуемое в зоне горения из-за химического и механического недожога. Qнедож зависит от вида горючего материала и условий горения и возрастает с увеличением количества воздуха, необходимого для полного сгорания (Qнедож составляет 5-25% от Qн);
Qпг - количество тепла, затрачиваемое на нагрев продуктов горения. За счет Qпг продукты горения нагреваются до температуры более 1000 °С (Qпг составляет 40-80% от Qн);
Qпот - количество тепла, теряемое из зоны горения конвекцией и излучением (Qпот составляет 40-60% от Qн);
Qн - низшая теплота сгорания вещества или материала. Этот показатель характеризует пожарную опасность вещества или материала.
Низшей теплотой сгорания Qн называется количество тепла, выделяемого при полном сгорании единицы массы или объема (кг, кмоль, м3) горючего вещества, при условии сгорания водорода до образования пара и испарения влаги горючего вещества (кДж/кмоль, кДж/кг, кДж/м3).
Различают также высшую теплоту сгорания Qв - это количество тепла, выделяемого при полном сгорании единицы массы или объема горючего вещества при условии, что содержащийся в нем водород сгорает с образованием жидкой воды и влага в веществе не испаряется. Эта величина имеет чисто теоретическое значение, т.к. температура горения намного выше 100°С, и всегда выделяющаяся вода при горении и влага вещества будут испаряться. Для расчетов параметров процессов горения используется низшая теплота горения.
Расчет теплоты горения
Для индивидуальных химических соединений низшую теплоту сгорания можно определить из следствия закона Гесса [2].
Теплота сгорания химического соединения равна разности между суммой теплот образования продуктов сгорания и теплотой образования сгоревшего химического соединения:
Qн = å(DН¦пг(i) × mi) - DH¦г × nг [кДж/моль]
где DН¦пг(i), DH¦г - соответственно теплота образования i-го продукта сгорания и горючего вещества;
mi, nг - стехиометрические коэффициенты в уравнении реакции горения.
Стандартные теплоты образования простых веществ (O2, N2 и т.д.) равны нулю.
Для сложных химических соединений низшую теплоту сгорания определяют по формуле Д.И. Менделеева:
Qн = 339,4×С + 1257×Н - 108,9(О - S) - 25(9×Н + W) [кДж/кг]
где C, H, S, W - содержание углерода, водорода, серы и влаги в горючем веществе (% вес.);
О - сумма кислорода и азота в горючем веществе (% вес.).
Для смеси газов низшую теплоту горения определяют как сумму теплот сгорания компонентов горючей смеси:
Qнсм = (åQнi × ji)/100 [кДж/м3; кДж/моль]
где Qнi - низшая теплота сгорания i-го компонента смеси газов;
ji - содержание i-го компонента в смеси газов (% об.).
Температура горения
Часть из выделяемого в зоне горения тепла расходуется на нагрев продуктов горения (Qпг).
Максимальная температура, до которой нагреваются продукты горения, называется температурой горения.
Различают следующие температуры горения:
- калометрическая – температура, до которой нагреваются продукты горения при следующих условиях: То = 273 К; aв = 1; Qпг = Qн;
- адиабатическая - если выполняются условия: То = 273 К; aв ¹ 1; Qпг = Qн;
- теоретическая - температура горения, когда учитывается часть тепла, расходуемого на диссоциацию продуктов горения и выполняются следующие условия: То = 273 К; aв = 1; Qпг = Qн - Qдисс;
- действительная температура горения - та температура, до которой нагреваются продукты горения в реальных условиях: То¹273 К; aв¹1; Qпг¹Qн.
| <== предыдущая страница | | | следующая страница ==> |
| ГОРЮЧЕСТЬ ВЕЩЕСТВ И МАТЕРИАЛОВ | | | ВОЗНИКНОВЕНИЕ ПРОЦЕССОВ ГОРЕНИЯ |
Дата добавления: 2014-10-14; просмотров: 1035; Нарушение авторских прав

Мы поможем в написании ваших работ!