
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры решения типовых задач 1 страница
ХИМИЯ
УЧЕБНОЕ ПОСОБИЕ
для студентов–заочников инженерно-технических
специальностей вузов
Тула 2007
Разработали: д.х.н. Аверьянов В.А., к.х.н. Карташова Т.Д., к.х.н. Дмитриева Е.Д., к.х.н. Хлебникова С.Ф.
УДК:67
Д.х.н. Аверьянов В.А., к.х.н. Карташова Т.Д., к.х.н. Дмитриева Е.Д. , к.х.н. Хлебникова С.Ф.
Химия. Методические указания, рабочая программа и контрольные задания для студентов–заочников инженерно-технических
специальностей вузов.
Пособие включает программу, методические указания, примеры решения типовых задач и контрольные задания по химии для студентов-заочников инженерно-технических специальностей вузов. Тематические разделы пособия выдержаны в строгом соответствии с содержанием программы курса химии для этих специальностей.
Пособие предназначено для самостоятельной работы студентов-заочников инженерно-технических специальностей вузов.
Программа ДИСЦИПЛИНЫ
Введение.
Химия как предмет естествознания. Связь химии с другими науками и объектами хозяйственной деятельности человека. Химические аспекты охраны окружающей среды.
Химическая реакция – основной объект изучения химии. Вещественная, энергетическая и кинетическая стороны химической реакции.
1. Строение вещества.
1.1. Строение атома и систематика химических элементов.
Квантово-механические представления о строении атомов. Волновое уравнение. Орбиталь. Квантовые числа. Электронные формулы. Принципы заполнения многоэлектронных атомов и их реализация. Периодическая система Д.И.Менделеева и электронная структура атомов элементов. Периодические свойства элементов и образуемых ими соединений. Предсказательная сила периодического закона.
1.2. Химическая связь.
Химическая связь. Определение и характеристики химических связей. Основные виды связей. Ковалентная связь. Метод валентных связей. Обменный и донорно-акцепторный механизмы образования химических связей. Метод молекулярных орбиталей. σ- и π-Связи. Гибридизация. Пространственное строение молекул. Силы межмолекулярных взаимодействий. Водородная связь.
2. Общие закономерности химических процессов.
2.1. Вещественная сторона химических реакций.
Закон сохранения вещества. Закон эквивалентов. Стехиометрические уравнения.
2.2. Энергетическая сторона химических процессов. Химическое равновесие.
Энергетика химических процессов. Понятие о термодинамических потенциалах. Внутренняя энергия и энтальпия. Первый закон термодинамики. Тепловые эффекты химических реакций. Законы Гесса. Термохимические расчеты. Направленность химических реакций. Факторы, определяющие направленность химических реакций. Энергия Гиббса, ее изменение как критерий направленности химических реакций. Химическое равновесие. Принцип смещения равновесия. Факторы смещения расновесия. Константа равновесия и ее связь с термодинамическими потенциалами.
2.3. Кинетическая сторона химических реакций.
Химическая кинетика. Основное уравнение химической кинетики. Факторы скорости химических реакций: концентрация, давление, температура, катализ. Порядок реакций как показатель количественного влияния концентрации реагентов на их скорость. Методы определения порядков реакций. Константа скорости химической реакции. Уравнения Аррениуса и Вант-Гоффа. Энергия активации как мера количественного влияния температуры на скорость реакции. Гомогенный катализ. Гетерогенный катализ. Фактор адсорбции в гетерогенном катализе.
3. Растворы. Электрохимические процессы.
3.1. Растворы.
Дисперсные системы. Их классификация. Растворы. Типы растворов. Способы выражения концентрации растворов. Растворы электролитов и неэлектролитов. Водные растворы электролитов. Сильные и слабые электролиты. Равновесия в растворах электролитов. Электролитическая диссоциация воды. Водородный показатель. Ионные реакции в растворах. Гидролиз солей.
3.2. Окислительно-восстановительные процессы. Электрохимия.
Окислительно-восстановительные реакции. Составление уравнений окислительно-восстановительных реакций. Электрохимические процессы. Гальванические элементы. ЭДС гальванического элемента и ее измерение. Понятия об электродных потенциалах. Электродные потенциалы металлических, газовых и окислительно-восстановительных электродов. Уравнение Нернста. Оценка направленности окислительно-восстановительных реакций. Электролиз. Последовательность электродных процессов. Выход по току. Электролиз с нерастворимыми и растворимыми анодами. Практическое значение электролиза.
3.3. Коррозия и защита металлов и сплавов от коррозии.
Коррозия. Определение и классификация коррозионных процессов. Химическая коррозия. Электрохимическая коррозия. Оценка направленности коррозионного процесса. Методы защиты металлов от коррозии: легирование, электрохимическая защита, защитные покрытия. Изменение свойств коррозионной среды. Ингибиторы коррозии.
4. Специальные разделы химии.
4.1. Химия комплексных соединений.
Комплексные соединения. Их классификация и номенклатура. Строение комплексных соединений. Методы получения комплексных соединений и их химические свойства. Диссоциация комплексных соединений.
4.2. Химия металлов.
Металлы. Физические и химические свойства металлов. Методы получения металлов. Металлические сплавы и композиты. Химия s-металлов. Химия некоторых p-металлов. Химия d-металлов IV-VIII групп периодической таблицы. Химия d-элементов I и II группы периодической таблицы.
4.3. Химия неметаллических элементов.
Неметаллы и полуметаллы. Зависимость свойств неметаллов от их положения в периодической таблице Д.И.Менделеева. Бор и его соединения. Элементы VI и VII групп и их соединения.
4.4. Элементы органической химии. Органические полимерные материалы.
Строение, классификация и свойства органических соединений. Углеводороды и их производные. Кремний-органические соединения. Состав и свойства органического топлива. Термохимия топлива. Твердое топливо и его переработка. Жидкое и газообразное топливо. Понятие о физико-химических процессах горения топлива. Химия смазочно-охлаждающих средств, применяемых при обработке металлов и сплавов. Физико-химические свойства и механизм воздействия рабочих сред гидравлических систем. Химия полимеров. Методы получения полимеров. Зависимость свойств полимеров от состава и структуры. Химия полимерных конструкционных материалов. Химия композиционных материалов. Полимерные покрытия и клеи. Химия полимерных диэлектриков. Химия полимерных проводников.
5. Химия и охрана окружающей среды.
Технический прогресс и экологические проблемы. Продукты горения топлива – загрязнители окружающей среды. Проблема парникового эффекта и кислотных дождей. Альтернативные источники энергии. Принципы создания малоотходных технологий. Загрязнители водного бассейна. Проблемы и методы очистки сточных вод. Создание замкнутых водооборотных систем. Твердые отходы, проблемы и методы их утилизации.
I. Контрольные задания
Каждый студент в течение межсессионного периода (семестра) выполняет две письменные контрольные работы. Вариант заданий по этим контрольным работам соответствует двум последним цифрам студенческого билета. Например, если номер студенческого билета 73842, то ему соответствует вариант № 42. Варианты для первой и второй контрольных работ и соответствующие им задания представлены в конце данного пособия.
1.1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ И ЕДИНИЦЫ ИХ ИЗМЕРЕНИЯ
Количество вещества (n) – это физическая величина, которая характеризует число структурных единиц (атомов, молекул, ионов, электронов, протонов, эквивалентов и др.) в определенной порции вещества.
Единица измерения количества вещества – моль.
Моль – количество вещества, содержащее столько же структурных единиц (молекул, атомов, ионов, электронов, эквивалентов и др.), сколько содержится атомов в 12 г изотопа углерода 12С, то есть 6,02·1023.
Это число (6,02·1023) называется числом Авогадро. Измеряется в моль-1.
Необходимо указывать, к каким структурным единицам относится понятие моль, например, «моль молекул водорода», «моль атомов водорода», «моль ионов водорода», «моль эквивалентов» и др.
Молярная масса – масса 1 моль вещества. Единица измерения г/моль.
Например, М(Н2О) = 18 г/моль, М(NaOH) = 40 г/моль, М(HNO3) = 63 г/моль.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять, высвобождать один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях.
Молярная масса эквивалентов – физическая величина, измеряемая произведением молярной массы вещества на фактор эквивалентности.
Молярная масса эквивалентов – масса 1 моль эквивалентов, т.е. 6,02·1023 эквивалентов. Обозначение М(fэкв.Х), М( 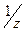 Х), Мэ(Х). Единица измерения г/моль.
Х), Мэ(Х). Единица измерения г/моль.
Фактор эквивалентности – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции.
Молярная масса – это абсолютная константа индивидуального вещества, молярная масса эквивалентов – константа вещества в конкретной реакции.
Фактор эквивалентности рассчитывается на основе стехиометрии данной реакции из равенства fэкв.(Х) = 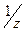 , где z -
, где z -
· в кислотно-основной реакции - основность кислоты или кислотность основания; определяется числом ионов водорода или гидроксид-ионов, участвующих в данной конкретной реакции;
· в окислительно-восстановительной реакции – число электронов, которые отдает или присоединяет частица в данной окислительно-восстановительной реакции.
Ниже приведены формулы для вычисления молярных масс эквивалентов сложных веществ:
| Современные рекомендуемые обозначения физических величин, примеры их записи и расчета | Ранее используемые обозначения физических величин, примеры их записи и расчета |
М( 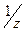 оксида)= оксида)= 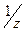 ·М(оксида)
М( ·М(оксида)
М( 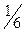 Al2O3)= Al2O3)= 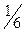 ·102= 17(г/моль) ·102= 17(г/моль)
|  
|
М( 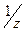 кислоты)= кислоты)= 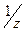 ·М(кислоты)
М( ·М(кислоты)
М( 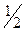 H2SeO4)= H2SeO4)= 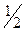 ·145=72,5(г/моль) ·145=72,5(г/моль)
| 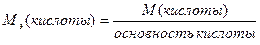 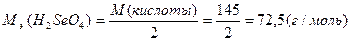
|
М( 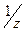 основания)= основания)= 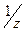 ·М(основания)
М( ·М(основания)
М( 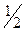 Ca(OH)2)= Ca(OH)2)= 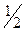 ·74=37(г/моль) ·74=37(г/моль)
| 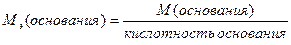 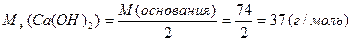
|
М( 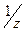 соли)= соли)= 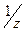 ·М(соли)
М( ·М(соли)
М( 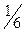 Fe2(SO4)3)= Fe2(SO4)3)= 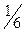 ·400=66,67(г/моль) ·400=66,67(г/моль)
|  
|
Молярная масса эквивалентов одного и того же вещества зависит от течения реакции:
H2SO4 + NaOH = NaHSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
В первом случае молярная масса эквивалентов H2SO4 равна ее молярной массе, во втором – половине молярной массы, так как в первом случае в реакции принимает участие один ион водорода (основность равна 1, fэкв=  ), а во втором – два иона водорода (основность равна 2, fэкв=
), а во втором – два иона водорода (основность равна 2, fэкв= 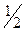 ).
).
М(  H2SO4)=1
H2SO4)=1  М(H2SO4)=98 (г/моль) или
М(H2SO4)=98 (г/моль) или 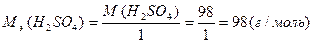
М( 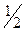 H2SO4)=
H2SO4)= 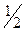
 М(H2SO4)=49( г/моль) или
М(H2SO4)=49( г/моль) или 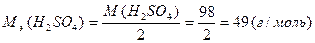
Для определения фактора эквивалентности и молярной массы эквивалента вещества в окислительно-восстановительной реакции необходимо написать уравнение реакции и электронный баланс реакции.
Например, для реакции взаимодействия натрия и серы запишем уравнение реакции и электронный баланс:
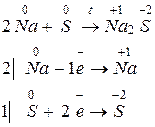
Каждый атом натрия отдает один электрон, а каждый атом серы принимает два электрона. Поэтому
fэкв(Na) = 1/1, fэкв(S) = 1/2.
Молярная масса эквивалента равна произведению фактора эквивалентности на молярную массу вещества:
Мэкв(Na) = fэкв(Na) · M(Na);
Ar (Na) = 23, M(Na) = 23 г/моль, Мэкв(Na) = (1/1)·23 = 23 (г/моль);
Мэкв(S) = fэкв(S) · M(S);
Ar (S) = 32, M (S) = 32 г/моль, Мэкв(S) = (1/2)·32 = 16 (г/моль).
Закон эквивалентов.
Закон эквивалентов дает количественное соотношение между массами вступающих во взаимодействие реагентов или связанных в химических соединениях элементов.
 =
= 
Из последнего соотношения следует:
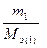 =
= 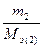 ,
,
т.е. число моль эквивалентов вступающих в реакцию или образующихся в результате реакции веществ равны между собой:
nэ 1 = nэ 2
Количественным выражением закона эквивалентов для реакций, протекающих в растворах, является соотношение:
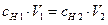 ,
,
где сн – нормальная концентрация вещества (молярная концентрация эквивалента).
Раствор, содержащий в одном литре один моль эквивалентов растворенного вещества, называется однонормальным (1,0 н.), 0,1 моль эквивалентов - децинормальным (0,1 н.), 0,01 моль эквивалентов – сантинормальным (0,01 н.)
Примеры решения типовых задач.
Пример 1. Расчет количества вещества по числу структурных единиц.
Задача 1. Какое количество вещества гидроксида меди (II) содержит 1,505·1023 атомов водорода?
Решение. Количество вещества гидроксид-ионов в гидроксиде меди (II), выраженное в моль, составляет:
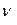 (ОН-) =
(ОН-) = 
В соответствие с формулой гидроксида меди (II) – Сu(OH)2 , в одной молекуле этого соединения содержится два гидроксид-иона. Это означает, что
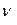 (Cu(OH)2) =
(Cu(OH)2) = 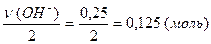 .
.
Пример 2. Расчет молярной массы эквивалента элемента по составу химического соединения на основе закона эквивалентов.
Задача 1. Оксид металла содержит 28,57% кислорода. Определите молярную массу эквивалента металла.
Решение. В соответствии с законом эквивалентов массы связанных между собой в химическом соединении металла m(Me)и кислорода m(O) пропорциональны молярным массам их эквивалентов
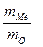 =
= 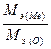 (1)
(1)
Полагая массу оксида равной 100 г, имеем m(O)=28,57 г и m(Me)=71,43г. Поскольку молярная масса эквивалента кислорода Мэ(О)=8г/моль, из выражения 1 находим молярную массу эквивалента металла:
Мэ(Ме)= 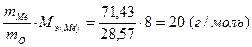
Пример 3. Расчет молярной массы эквивалента вещества по массе и объему участвующих в реакции веществ на основе закона эквивалентов.
Задача 1. 2,14 г металла вытесняют из кислоты 2 л водорода (н.у.). Вычислите молярную массу эквивалента металла.
Решение. Согласно закону эквивалентов количество вещества эквивалентов металла равно количеству вещества эквивалентов водорода
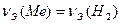 (2)
(2)
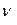 э.(Me) =
э.(Me) = 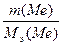 ;
; 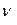 э.(H2) =
э.(H2) =  , где (3)
, где (3)
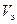 (H2) – эквивалентный объем водорода, равный
(H2) – эквивалентный объем водорода, равный
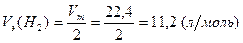 ;
;
Vm – молярный объем газа при н.у., равный 22,4 л/моль.
Тогда в соответствии с выражениями (2) и (3)

 , откуда
, откуда
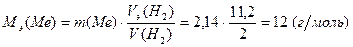 .
.
Пример 4. Расчет молярной массы эквивалента элемента по соотношению масс реагента и продукта реакции на основе закона эквивалентов.
Задача 1. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалента металла.
Решение. В соответствии с законом эквивалентов соотношение масс нитрата и гидроксида металла равно
 =
=  (4)
(4)
Молярные массы эквивалентов нитрата и гидроксида металла равны
Mэ1 = Mэ(Me) + Mэ(NO3-) = Mэ(Me) + 62
Mэ2 = Mэ(Me) + Mэ(OH-)= Mэ(Me)+17
Подставляя эти выражения в уравнение (4) имеем
 =
=  или
или  =
=  .
.
Решая последнее уравнение относительно Mэ(Me), имеем
Mэ(Me)=15г/моль.
Пример 5. Определение молекулярной массы газообразного вещества на основе его плотности.
Задача 1. Масса 1 л газа при н.у. равна 1,175 г. Вычислите молекулярную массу газа и массу одной молекулы газа.
Решение. Поскольку один моль газа при нормальных условиях занимает объем 22,4 л, его молярная масса равна
М(газа) = 1,175·22,4 = 26,32 (г/моль).
Поскольку в 1 моль любого вещества содержится 6,02·1023 молекул, масса одной молекулы определяется по формуле
m= 
Пример 6. Определение фактора эквивалентности и молярной массы эквивалента вещества в окислительно-восстановительной реакции.
Задача 1. При взаимодействии алюминия и серы образуется сульфид алюминия. Вычислите факторы эквивалентности и молярные массы эквивалентов алюминия и серы.
Решение. Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Реакция взаимодействия алюминия и серы протекает согласно уравнению:
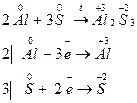
Каждый атом алюминия отдает три электрона, а каждый атом серы принимает два электрона. Поэтому
fэкв(Al) = 1/3, fэкв(S) = 1/2.
Молярная масса эквивалента вещества – это масса вещества, эквивалентная 1 моль ионов водорода в кислотно-основной реакции или 1 моль электронов в окислительно-восстановительной реакции. Молярная масса эквивалента равна произведению фактора эквивалентности на молярную массу вещества:
М экв(Al) = fэкв(Al) · M(Al);
Ar (Al) = 27; M(Al) = 27 г/моль; Мэкв (Al) = 1/3·27 = 9 г/моль;
Мэкв(S) = fэкв(S) · M(S);
Ar (S) = 32; M(S) = 32 г/моль; Мэкв(S) = 1/2·32 = 16 г/моль.
1.2. СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ СИСТЕМА химических ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
Периодичность свойств элементов и
их соединений.
Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе.
Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z. Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента – Z.
Номер периода показывает число энергетических электронных уровней в атоме.
Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне.
Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное – буквой (s-, p-, d-, f-), а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота  Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного
Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного  . Например, для атома азота электронно-графическая формула имеет вид:
. Например, для атома азота электронно-графическая формула имеет вид:
| ↓↑ | ↓ | ↓ | ↓ | |||||||||||||||
| ↓↑ | 2s | 2p |
1s
Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
| Основное состояние | Возбуждённое состояние | ||||||||||||||
| 1s2 2s2 | ↓↑ | 
| 1s2 2s1 2p1 | ↓ | ↓ | ||||||||||
| ↓↑ | 2s | 2p | ↓↑ | 2s | 2p | ||||||||||
| 1s | 1s | ||||||||||||||
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу  , это d – элемент.
, это d – элемент.
| <== предыдущая страница | | | следующая страница ==> |
| Краткие сведения о классификации и номенклатуре растений | | | Примеры решения типовых задач 2 страница |
Дата добавления: 2014-10-14; просмотров: 600; Нарушение авторских прав

Мы поможем в написании ваших работ!