
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры решения типовых задач 3 страница
Пример 5. Определение элементов по строению наружного и предпоследнего электронных слоев их атомов.
Задача 1. Атомы каких элементов имеют следующее строение наружного и предпоследнего электронных слоев:
а) 2s2p63s23p1;
б) 3s23p63d34s2;
в) 4s24p64d105s0.
Решение. В случае а имеем дело с незаполненным р-подуровнем 3-го энергетического уровня, причем этот подуровень содержит один электрон и соответствует первому р-элементу 3-го энергетического уровня. Это 13Al. Его полная электронная формула 1s22s2p63s2p1.
Случай б соответствует незаполненному d-подуровню 3-го энергетического уровня. Поскольку наружный слой содержит максимальное число s-электронов (4s2), то с учетом 3-х электронов на незаполненном 3d-подуровне, это соответствует 3-му по счету d-элементу 4-го периода, то есть 23V. Его полная электронная формула: 1s22s22p63s23p63d34s2.
Случай в соответствует полностью заполненному 4d-подуровню (10 электронов), однако внешний 5s-подуровень пуст. Это означает, что произошел провал 2-х электронов с 5s- на 4d-подуровень, что соответствует восьмому по счету d-элементу (10-2=8) в пятом периоде. Этот элемент – 46Pd. Его полная электронная формула: 1s22s22p63s23p63d104s24p64d105s0.
Пример 6. Определение типа радиоактивного распада на основе баланса между массами и зарядами исходных частиц и конечных продуктов.
Задача 1. Какой тип радиоактивного превращения имел место в следующих переходах ядер:
а) 111Pd → 111Ag б) 222Rn → 218Po
Решение. В случае а масса ядра сохраняется, но порядковый номер, а следовательно заряд ядра атома увеличивается на 1. Такая ситуация соответствует ß-распаду, поскольку в силу закона сохранения заряда увеличение заряда ядра атома на 1 должно быть сбалансировано единичным отрицательным зарядом, носителем которого является электрон (ß-частица). В то же время масса электрона пренебрежимо мала по сравнению с массой любого из нуклонов (протон или нейтрон), и ß-распад не приводит к изменению ядра атома:
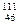 Pd →
Pd →  Ag + ß-
Ag + ß-
В случае б масса полученного в результате ядерной реакции атома полония больше массы исходного радона на 4 единицы, а заряд ядра в результате ядерной реакции снижается на 2. Такое различие в массе и заряде соответствует выбросу 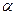 -частицы:
-частицы:

Пример 7. Изменение свойств элементов в больших периодах периодической системы.
Задача 1. Каков характер изменения свойств элементов в четвертом периоде периодической системы?
Решение. Четвертый период содержит 18 элементов от К (z=19) до Kr (z=36). В атомах элементов третьего периода заполнены электронами только s- и р-орбитали третьего энергетического уровня, десять d-орбиталей остаются свободными. Но у атомов элементов четвертого периода начинает заполняться электронами 4s-орбиталь (при наличии свободных d-орбиталей), так как ядро экранируется плотным электронным слоем 3s23p6. Заполнение d-оболочки третьего уровня начинается у Sc (z=21) и 3d1 и заканчивается у Cu (z=29) 3d10. Постепенное заполнение электронами d-орбиталей третьего уровня нарушается у атомов Cr и Cu, у которых происходит «провал» электрона в s-состоянии (с четвертого) внешнего энергетического уровня на предпоследний (третий). Десять элементов четвертого периода (Sc-Zn), в атомах которых застраивается d-оболочка третьего (предпоследнего) уровня, называют переходными. После цинка до криптона продолжается заполнение р-орбиталей четвертого энергетического уровня.
В четвертом периоде между типичным металлом (К) и типичным неметаллом (Br) находятся 15 элементов (а не пять, как, например, в третьем периоде), из них 10 переходных элементов. Переходные элементы, в атомах которых заполняются d-оболочки предпоследнего уровня, меньше отличаются друг от друга по свойствам, чем элементы малых периодов. В больших периодах, в частности в четвертом, ослабление металлических свойств элементов происходит медленнее, чем в малых периодах (только в конце периода находятся неметаллы). В больших периодах большинство элементов – металлы.
Пример 8. Изменение свойств элементов в главных и побочных подгруппах периодической системы.
Задача 1. Как изменяются металлические свойства элементов в главных и побочных подгруппах периодической системы с увеличением заряда ядра атома элемента?
Решение. Главные подгруппы в группах периодической системы образуют s- и p-элементы, а побочные – d-элементы.
В главных подгруппах с увеличением заряда ядра атома элемента увеличивается радиус атома элемента, так как в этом направлении возрастает число электронных слоев в атоме элемента. Поэтому в главной подгруппе сверху вниз нарастают металлические (восстановительные) свойства элементов.
В побочных подгруппах при переходе от первого элемента ко второму происходит увеличение радиуса атома элемента, а при переходе от второго элемента к третьему даже некоторое уменьшение. Это объясняется f-(лантаноидным) сжатием. Поэтому в побочных подгруппах с увеличением заряда ядра уменьшаются металлические свойства (за исключением побочной подгруппы третьей группы).
Поэтому в пределах одной группы свойства элементов главной и побочных подгрупп различны. Различия в свойствах элементов главных и побочных подгрупп значительны для первой группы, затем оно ослабевает. Так, элементы главной и побочной подгрупп третьей группы сравнительно близки по свойствам. Затем это различие в свойствах вновь усиливается и делается очень существенным в седьмой группе, где элементы подгруппы Mn сильно отличаются от галогенов.
Пример 9. Прогнозирование изменения свойств соединений элементов на основе изменения электроотрицательности этих элементов.
Задача 1. Как изменится сила кислот в ряду HOCl → HOBr → HOI? Как изменятся окислительные свойства этих кислот?
Решение. Свойством, определяющим силу кислот указанного ряда, является электроотрицательность атомов галогенов. Чем больше электроотрицательность галогена, тем в большей степени стабилизирован анион кислоты (О–Hal)–, образующийся в результате акта отдачи протона, то есть реализации кислотности. Поскольку электроотрицательность атомов галогенов изменяется в ряду Cl > Br > I, то кислотность кислот изменяется симбатно: HOCl > HOBr > HOI. В основе реализации окислительных свойств HOHal лежит также электроотрицательность, поскольку акту принятия электронов способствует способность атома притягивать электроны. Поэтому окислительные свойства этих кислот следуют ряду: HOCl > HOBr > HOI.
Пример 10. Прогнозирование изменения свойств соединений элементов на основе изменения радиусов этих элементов.
Задача 1. Как изменяются основные свойства и растворимость в воде гидроксидов щелочных металлов в ряду LiOH → CsOH?
Решение. Основность гидроксидов – способность их к отщеплению гидроксид-аниона. Чем прочнее этот анион связан с катионом металла, тем меньшую основность проявляет гидроксид. Поскольку в ряду LiOH → CsOH радиус катиона увеличивается, расстояние между центрами зарядов катиона металла и гидроксид-аниона (кулоновский радиус) также увеличивается. Это приводит к ослаблению сил кулоновского притяжения между разноименно заряженными частицами и увеличению способности гидроксида к продуцированию гидроксид-аниона. Поэтому в ряду LiOH → CsOH основность возрастает.
В то же время с увеличением кулоновского радиуса, возрастает степень поляризации ионной пары «катион металла – гидроксид-анион», а следовательно, способность этой пары к гидратации и последующей диссоциации. Это приводит к увеличению растворимости гидроксидов в ряду LiOH → CsOH.
1.3. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ.
Под химической связью понимается совокупность взаимодействий, обусловливающих устойчивое существование различных частиц: молекул, ионов, кристаллических и иных веществ.
К основным критериям наличия химических связей следует отнести:
а) снижение обшей энергии многоатомных систем по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
б) перераспределение электронной плотности химически связанных частиц по сравнению с простым наложением электронных плотностей несвязанных атомов, приближение друг к другу на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Важными количественными характеристиками химической связи являются энергия и длина связи.
Энергия химической связи (D) – количество энергии, которое выделяется при образовании данной химической связи из атомов.
Для многоатомных молекул с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, поскольку энергия, поглощаемая в процессе Н2О = 2Н + О равна 924 кДж/моль, а в молекуле воды обе связи О – Н химически эквивалентны, то средняя энергия связи D(O-H) = Dдисс../2 = 924/2 = 462 кДж/моль.
Важной характеристикой химической связи является ее длина l, равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Для однотипных видов связи имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и, соответственно, устойчивость молекул. Например, для молекул галогенводородов в ряду
l(НF) < l(HCl) < l(HBr) < l(HI)
растет длина связи и уменьшается ее энергия
D(H-F) > D(HCl) > D(HBr) >D(HI).
Основными видами химической связи являются ионная, ковалентная и металлическая.
Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает в случае большого различия электроотрицательности атомов, участвующих в образовании связей. Подобная ситуация имеет место при образовании связей между катионами s-элементов (металлов) первой и второй групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, K2O и др.). Высокое различие в электроотрицательности (ЭО) атомов обусловливает практически полный переход электронов от атомов с низкой ЭО к атомам с высокой ЭО и их ионизацию. В результате доминирующий вклад в энергию связывания вносит кулоновское взаимодействие между противоположно заряженными ионами.
Ковалентной является химическая связь, образованная путем обобществления пары электронов двумя атомами. При сближении двух атомов, например, атомов хлора, происходит перекрывание их орбиталей.

Cl Cl
В результате электронная плотность между ядрами их атомов возрастает, и ядра притягиваются друг к другу. При чрезмерном сближении возрастает отталкивание ядер. Противоборство этих двух сил обусловливает энергетический минимум на потенциальной кривой взаимодействия атомов, равный энергии связи.

Этому минимуму соответствует оптимальное расстояние между ядрами, равное длине связи lсв.
Особенностями ковалентной химической связи являются ее направленность и насыщаемость.Так как атомные орбитали пространственно ориентированы, то их перекрывание происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах. Насыщаемость ковалентной связи обусловлена ограничением числа электронов, участвующих в ее образовании.
Удобным параметром для описания размера атома, участвующего в образовании ковалентной связи, является ковалентный радиус rков. Его определяют для атома Х как половину длины типичной простой гомоядерной связи Х–Х.
Если ковалентная связь образуется одинаковыми атомами, например Н–Н, О=О и др., то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью. Если же один из атомов обладает большей электроотрицательностью по сравнению с другим, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае возникает ковалентная полярная связь. При этом чем больше разница в электроотрицательности атомов, образующих связь, тем больше полярность связи. В результате смещения электронов от одного атома к другому на одном из них (более электроотрицательном) образуется частичный отрицательной заряд ( 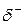 ), на другом – частичный положительный заряд (
), на другом – частичный положительный заряд ( 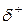 ). В результате образуется диполь – нейтральная система с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися друг от друга на расстоянии lD, называемым длиной диполя. Мерой полярности связи является электрический момент диполя
). В результате образуется диполь – нейтральная система с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися друг от друга на расстоянии lD, называемым длиной диполя. Мерой полярности связи является электрический момент диполя  , равный произведению эффективного заряда
, равный произведению эффективного заряда 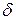 на длину диполя
на длину диполя
 =
= 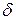 . lD.
. lD.
Полярную ковалентную связь с 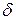 , приближающимся к 1, можно считать ионной связью. Однако даже у ионных соединений
, приближающимся к 1, можно считать ионной связью. Однако даже у ионных соединений 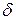 ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
При описании распределения электронов в молекулах используют два основных метода расчета: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Метод валентных связей
Метод ВС основан на следующих основных положениях:
а) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобщенных двух электронов);
б) атомы, образующие химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит свой вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
в) в образовании химической связи участвуют электроны с антипараллельными спинами;
г) характеристики химической связи (энергия, длина, полярность и др.) определяется типом перекрывания АО.
Электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. Например, электронные орбитали в молекуле водорода не имеют сферической симметрии в отличие от АО атома водорода, так как электронная пара принадлежит двухцентровой молекулярной системе. В то же время эта связывающая электронная пара находится на более низком энергетическом уровне, чем неспаренные электроны атомов водорода.
В результате образования молекул из атомов изменения претерпевает лишь электронная структура внешних и предвнешних оболочек атомов. Поэтому в образовавшейся молекуле атомы с исходной электронной структурой не существуют. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихся при образовании связей.
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью. Согласно методу ВС, каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС является число неспаренных электронов у атома в основном или возбужденном состоянии. К ним относятся неспаренные электроны внешних оболочек атомов s- и р-элементов, внешних и предвнешних оболочек d-элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары или пар электронов и переходе одного (или нескольких электронов, равных числу разъединенных пар) на свободную орбиталь той же оболочки. Например, электронная конфигурация кальция в основном состоянии записывается как 4s2. В соответствии с обменным механизмом метода ВС валентность его равна нулю, т.е. для Са (…4s2) валентностьВ=0. У атома кальция в четвертой оболочке (п=4) имеются вакантные р-орбитали. При возбуждении атома происходит распаривание электронов и один из 4s-электронов переходит на свободную 4s-орбиталь. Валентность кальция в возбужденном состоянии равна двум, т.е. при распаривании валентность увеличивается на две единицы.
| 4s | 4p | 4s | 4p | |||||||||||||||
| Ca | ↑↓ | → | Ca* | ↑ | ↑ | B*=2 | ||||||||||||
В отличие от кислорода и фтора, электронные пары которых не могут разъединяться, т.к. на втором уровне нет других вакантных орбиталей, электронные пары серы и хлора могут распариваться, т.к. на третьем уровне есть вакантные 3d-орбитали. Соответственно сера, кроме валентности основного состояния I и II,
| 3s | 3p | 3d | ||||||||
| ↑↓ | ↑↓ | ↑ | ↑ |
имеет еще валентности IV и VI в возбужденных состояниях:
| 3s | 3p | 3d | ||||||||
| ↑↓ | ↑ | ↑ | ↑ | ↑ | ||||||
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
Пространственная структура молекул.
Как было показано ранее, ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями АО в пространстве.
Связь, образованная перекрыванием АО по линии, соединяющей ядра соединяющихся атомов, называется σ-связью. Примерами образования σ-связей являются перекрывания s-орбиталей, s- и p-орбиталей, р-орбиталей, d-орбиталей, а также d- и s-орбиталей, d- и р-орбиталей и т.д. Некоторые из примеров σ-связей приведены ниже.

Можно видеть, что в случае σ-связей область максимальной электронной плотности находится на линии, соединяющей ядра атомов.
Связь, образованная перекрыванием АО по обе стороны от линии, соединяющей ядра атомов (боковое перекрывание), называется π-связью. π-связь может образоваться при перекрывании р-р, р-d, f-p, f-d и f-f-орбиталей. Ниже приведены примеры образования π-связей.

Поскольку при образовании π-связей степень перекрывания орбиталей невелика по сравнению с σ-связями, энергия этих связей существенно ниже.
При наложении π-связи на σ-связь образуется двойная связь, например, в молекулах кислорода, этилена, диоксида углерода:
 |  |

 О=О , С=С , О=С=О.
О=О , С=С , О=С=О.
При наложении двух π-связей на одну σ-связь возникает тройная связь, например, в молекулах азота, ацетилена, синильной кислоты:
 ,
, 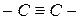 ,
,  .
.
Чем выше кратность связи, тем больше ее энергия и тем меньше длина связи.
Некоторые формы соединений невозможно объяснить с точки зрения их образования из возбужденных или невозбужденных атомов. Так, в молекуле метана все связи С-Н равноценны, что противоречит набору орбиталей у возбужденных и невозбужденных форм атома углерода. Последовательное обоснование этого и других фактов найдено в рамках концепции гибридизации АО.
Гибридизация - это смешение различных по энергии и форме орбиталей атома, приводящие к образованию такого же количества одинаковых по энергии и форме гибридных орбиталей. Эквивалентность гибридных орбиталей обусловливает не только образование равноценных по энергии связей, но и одинаковые валентные углы между связями, образуемыми этими орбиталями. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали, причем объектом гибридизации являются орбитали, имеющие близкие значения энергии.
В случае метана гибридизация является результатом смешения одной s- и трех р-орбиталей в возбужденном состоянии атома углерода, так называемая sp3-гибридизация.
 sp3
sp3
| 2p | 2p | ||||||||||||
| 2s | ↑ | ↑ | → | 2s | ↑ | ↑ | ↑ | → | ↑ | ↑ | ↑ | ↑ | |
| ↑↓ | ↑ |
Образование гибридных орбиталей обусловливает энергетическую выгодность образующихся посредством этих орбиталей химических соединений. Это связано с двумя факторами.
Во-первых, гибридные орбитали ассимметричны, что обусловливает большую степень перекрывания при образовании ими химических связей и большую их прочность.
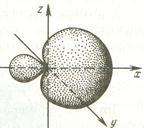
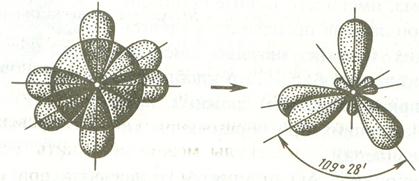
Во-вторых, валентные углы между гибридными орбиталями больше, чем негибридными, что обусловливает меньшую степень отталкивания между электронами связей, образуемых этими орбиталями, и делает молекулярные системы более стабильными.
При sp3-гибридизации продольные оси симметрии гибридных орбиталей находятся по отношению друг к другу под углом 109º28' – соответствующих их направлению к углам тетраэдра, центром которого является ядро атома.
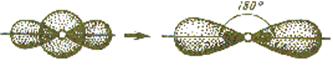
Если объектами гибридизации является одна s и две р-орбитали, то такой тип гибридизации называется sp2- гибридизация, а углы между продольными осями этих орбиталей равны 120ºС и соответствуют минимальному отталкиванию между валентными электронами.

При смешении одной s- и одной р-орбитали имеет место sp-гибридизация. В этом случае валентный угол между гибридными орбиталями составляет 180˚ С.
Пространственная структура молекул определяется числом атомов в молекуле, гибридизацией орбиталей и числом неспаренных электронов на них, ответственных за образование связей.
Молекула, образованная двумя атомами, линейна. Если на внешней оболочке атома имеется два неспаренных р-электрона, то при перекрывании их АО орбиталями других атомов, образуется угловые молекулы. К таким атомам относятся атомы р-элементов VI группы (O, S, Se, Te), электронная конфигурация внешних оболочек которых приведена ниже.
| ns | np | ||||
| ↑↓ | ↑↓ | ↑ | ↑ |
Две р-орбитали с неспаренными электронами расположены перпендикулярно друг к другу, поэтому угол в молекулах H2S, H2Se и H2Te близок к 90˚. Вследствие отталкивания электронов валентный угол между связями в молекуле H2S несколько выше 90˚. У молекул воды угол между связями значительно больше и равен 105˚. Такую структуру можно объяснить, если принять, что это происходит sp2 гибридизация АО кислорода при образовании воды. При этом две гибридные орбитали перекрываются s-орбиталями водорода. Отталкивание валентных электронов связей Н-О от неподеленных пар электронов кислорода обусловливает уменьшение валентного угла от 120о до 105˚.
Образование молекул аммиака можно представить через sp3-гибридизацию невозбужденного атома азота.
| 2p | 
| |||||||
| 2s | ↑ | ↑ | ↑ | → | ↑ | ↑ | ↑ | ↑↓ |
| ↑↓ |
невоздужденное sp3 -гибридизация
| <== предыдущая страница | | | следующая страница ==> |
| Примеры решения типовых задач 2 страница | | | Примеры решения типовых задач 4 страница |
Дата добавления: 2014-10-14; просмотров: 627; Нарушение авторских прав

Мы поможем в написании ваших работ!