
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры решения типовых задач 4 страница
состояние атома
Три орбитали с неспаренными электронами образуют химические связи с атомами водорода, давая пирамидальную структуру, а оставшаяся неподеленная электронная пара азота, отталкивая от себя валентные электроны, понижает валентные углы с тетраэдрических (109˚28') до 108º.
Метод молекулярных орбиталей
Согласно методу МО электроны в молекулах распределены по МО, которые подобно АО характеризуются определенной энергией и формой. В отличие от АО, молекулярные орбитали охватывают систему атомов, т.е. являются многоцентровыми.
Наиболее широко в методе МО используется линейная комбинация АО (ЛКАО). При образовании МО из соответствующих АО должны соблюдаться следующие правила:
1. Число МО равно общему числу АО, из которых комбинируется МО.
2. Энергия одних МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО.
3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип Паули и правило Гунда .
4. Наиболее эффективно комбинируются между собой те АО, которые характеризуются соответствующими энергиями и соответствующей симметрией.
5. Как и методе ВС, прочность связи в методе МО пропорциональна степени перекрывания орбиталей.
Если обозначить АО атомов А и В через 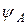 и
и 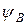 , а МО через
, а МО через  , то согласно ЛКАО
, то согласно ЛКАО
 ,
,
где:  – волновая функция электрона в молекуле (МО); a и b – коэффициенты, учитывающие долю каждой АО в образовании МО;
– волновая функция электрона в молекуле (МО); a и b – коэффициенты, учитывающие долю каждой АО в образовании МО;
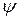 и
и 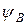 – волновые функции электронов (АО) атомов А и В соответственно.
– волновые функции электронов (АО) атомов А и В соответственно.
При знаке плюс получаются связывающие МО, при знаке минус – разрыхляющие МО (обозначаемые знаком *). Образование МО молекулы водорода из s-AO атомов водорода можно представить следующей энергетической диаграммой.

Можно видеть, что согласно вышеприведенным правилам заполнения МО, образующаяся молекула Н2 обладает минимумом энергии, что обусловливает ее стабильность.
Примеры решения типовых задач.
Пример 1. Расчет энергии связи.
Задача 1. Вычислите энергию связи H-S в молекуле H2S по следующим данным: 2H2 (г) + S2 (г) = 2 H2S (г) – 40,30 кДж; энергии связей D(H-H) и D(S-S) соответственно равны –435,9 кДж/моль и – 417,6 кДж/моль.
Решение. Образование двух молекул H2S можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей S-S в молекуле S2:
2 H-H  4 Н
4 Н  – 2D(H-H)
– 2D(H-H)
S-S  2 S
2 S  – D(S-S)
– D(S-S)
4 Н  + 2 S
+ 2 S 
 2 H2S + 4D(S-H),
2 H2S + 4D(S-H),
где D(H-H), D(S-S) и D(S-H) – энергии образования связей H-H, S-S и S-Н соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению
2H2 (г) + S2 (г) = 2 H2S (г) –2D(H-H) – D(S-S) + 4D(S-H).
Тепловой эффект этой реакции равен
Q = –2D(H-H) – D(S-S) + 4D(S-H), откуда
D(S-H) = 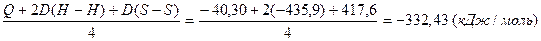 .
.
Пример 2. Вычисление длины связи.
Задача 1. Рассчитайте длину связи в молекуле HBr, если межъядерное расстояние в молекулах Н2 и Br2,равны 0,74∙10-10 и 2,28∙10-10м соответственно.
Решение. Длина ковалентной связи между двумя разноименными атомами равна сумме их ковалентных радиусов
l(H-Br) = r(H) + r(Br).
В свою очередь, ковалентный радиус атома определяется как половина межъядерного расстояния в молекулах Н2 и Br2:
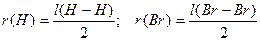 .
.
Таким образом,
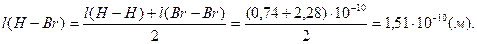
Пример 3. Определение вида гибридизации орбиталей и пространственной структуры молекулы.
Задача 1. Какой вид гибридизации электронных облаков имеет место в атоме кремния при образования молекулы SiF4? Какова пространственная структура этой молекулы?
Решение. В возбужденном состоянии структура внешнего энергетического уровня атома кремния следующая:
| 3s | 3p | ||
| ↑ | ↑ | ↑ | ↑ |
| 3s | 3px | 3py | 3pz |
В образовании химических связей в атоме кремния участвуют электроны третьего энергетического уровня: один электрон в s-состоянии и три электрона в р-состоянии. При образовании молекулы SiF4 возникают четыре гибридных электронных облака (sp3-гибридизациия). Молекула SiF4 имеет пространственную тетраэдрическую конфигурацию.
Пример 4. Определение валентностей элементов в химических соединениях на основе анализа графических электронных формул основного и возбужденных состояний атомов этих элементов.
Задача 1. Какую валентность, обусловленную неспаренными электронами, может проявлять сера в основном и в возбужденном состоянии?
Решение. Распределение электронов внешнего энергетического уровня серы …3s23p4 с учетом правила Гунда имеет вид:
| s | p | d | |||||||
| 16S | ↑↓ | ↑↓ | ↑ | ↑ |
Атомы серы имеют свободные d-орбитали, поэтому возможен переход спаренных 3р- и 3s- электронов на 3d подуровень, что приводит к двум возбужденным состояниям:
| s | p | d | |||||||
| 16S | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| s | p | d | |||||||
| 16S | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
Из анализа основного и двух возбужденных состояний следует, что валентность (спинвалентность) серы в нормальном состоянии равна двум, в первом возбужденном состоянии – четырем, во втором – шести.
Пример 5. Использование метода молекулярных орбиталей (МО) для описания строения молекул.
Задача 1. а) Обоснуйте радикальный характер молекулы оксида азота (II) с помощью метода МО.
Решение. Молекула NO образуется путем взаимодействия атомных орбиталей внешних электронов атомов азота и кислорода, т.е. 2s- и 2p- орбиталей. Со стороны каждого атома во взаимодействии участвуют 4 орбитали (одна 2s- и три 2р-орбитали). Следовательно, при общем количестве взаимодействующих орбиталей, равном восьми, образуется 8 молекулярных орбиталей. При этом взаимодействие двух 2s-орбиталей атомов азота и кислорода приводит к одной σS-связывающей и одной σS*-разрыхляющей орбитали. Аналогично, взаимодействие двух 2р-орбиталей этих атомов дает одну σр-связывающую и одну σр*-разрыхляющую орбиталь. Взаимодействие четырех остающихся р-орбиталей (по две от каждого атома) приводит к образованию двух связывающих и двух разрыхляющих π- орбиталей. Изложенные соображения иллюстрируются следующей схемой образования МО:
| · : N · · _↑__↑_ _↑_ 2р 2р 2р _↑↓_ 2s |
NO
___
_↑_ σр* ______
  _↑↓__↑↓_
_↑↓__↑↓_
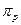 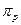 _↑↓_
σр
_↑↓_
σs*
_↑↓_
σs
_↑↓_
σр
_↑↓_
σs*
_↑↓_
σs
| · : O : · _↑↓__↑_ _↑_ 2р 2р 2р _↑↓_ 2s |
В соответствии с порядком заполнения МО (в первую очередь заполняются МО с меньшей энергией) произведено размещение электронов, ранее находящихся на внешнем уровне атомов N и O, на молекулярные орбитали NO. Можно видеть, что, во-первых, взаимодействие р-орбиталей приводит к энергетическому минимуму, обусловливающему статичность молекулы NO; во-вторых, на одной из разрыхляющих π*-орбиталей находится один электрон, обусловливающий радикальный характер молекулы NO.
Задача 2. б) Обоснуйте с помощью метода МО, почему гелий является одноатомным газом.
Решение. Представим себе образование двухатомной молекулы гелия через взаимодействие 1s орбиталей его атомов 2He. Такое взаимодействие приводит к образованию одной связывающей σ-орбитали и одной разрыхляющей σ*-орбитали. Представим это взаимодействие схемой:
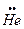
| 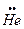
| |
| _↑↓_ 1s | _↑↓_ σs* _↑↓_ σs | _↑↓_ 1s |
Можно видеть, что размещение принадлежащих атомам гелия четырех электронов не приводит к общему понижению энергии (формированию энергетического минимума), так как стабилизация, достигнутая при заполнении связывающей МО, теряется при заполнении разрыхляющей МО. Поэтому 2 атома гелия не могут удерживаться в молекулярной структуре He2.
Пример 6. Оценка энергий МО межмолекулярных взаимодействий на основе температуры кипения соединений.
Задача 1. Объясните наблюдаемые различия в температурах кипения у следующей группы соединений с близкой молекулярной массой.
| Соединение | Ткип,оС |
| CH3CH2CH2CH3 | |
| CH3CH2OCH3 | |
| CH3CH2CHO | |
| CH3CH2CH2OH |
Решение. Н-бутан содержит в своей структуре атомы углерода в sp3-состоянии и атомы водорода, близкие по своей электроотрицательности и слабо поляризуемые. Это обусловливает слабость сил диполь-дипольного, индукционного и дисперсионного взаимодействий между молекулами и неустойчивость молекулярных ассоциатов. В метилэтиловом эфире появляются предпосылки для дисперсионных взаимодействий из-за более высокой неполяризуемости атома этого ряда по сравнению с углеродом. Из-за полярности связей С–О увеличивается по сравнению с н-бутаном сила диполь-дипольных и индукционных взаимодействий. Молекула пропионового альдегида характеризуется сильно полярной связью С=О из-за дополнительного смещения π-электронов к электроотрицательному атому кислорода. Это обусловливает возрастание по сравнению с метилэтиловым эфиром сил индукционного и диполь-дипольного взаимодействия и общее упрочнение межмолекулярных связей, что требует более высокой энергии для разрыва этих связей, т.е. более высокой температуры кипения. Наконец, в молекуле спирта появляются структурные предпосылки для образования более прочных по сравнению с Ван-дер-Ваальсовыми взаимодействиями водородных связей: наличие кислого водорода связи Н–О и электроотрицательного атома кислорода.
··· Н – О ·· Н – О ··· Н – О ···
| | |
R R R
Разрыв таких связей в процессе испарения требует еще большей энергии, и, соответственно, более высокой температуры.
1.4. Энергетика химических реакций.
Энергетическая сторона реакций изучается в разделах химии, называемых термохимией и химической термодинамикой.
Термодинамика на основе энергетических критериев – термодинамических потенциалов дает ответ на вопрос: осуществим ли принципиально тот или иной химический процесс в данных условиях или нет. Изменение термодинамических потенциалов, характеризующее данный процесс, является его движущей силой. Наиболее часто в качестве движущей силы используется изменение энергии Гиббса, или изобарно-изотермического потенциала 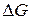 , характеризующего переход процесса из начального в конечное состояние (реагентов, или исходных веществ, в продукты реакции) при постоянстве температуры и давления в системе:
, характеризующего переход процесса из начального в конечное состояние (реагентов, или исходных веществ, в продукты реакции) при постоянстве температуры и давления в системе:
 (1)
(1)
Если  , то процесс принципиально осуществим, если
, то процесс принципиально осуществим, если 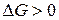 , то процесс невозможен. Чем меньше
, то процесс невозможен. Чем меньше 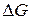 , тем сильнее стремление к протеканию процесса и тем дальше он от состояния равновесия, при котором
, тем сильнее стремление к протеканию процесса и тем дальше он от состояния равновесия, при котором 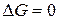 .
.
Изменение энергии Гиббса является результатом вклада двух факторов: энтропийного и энтальпийного.
Энтропийный фактор, характеризующий изменение энтропии системы при переходе из начального в конечное состояние
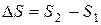 (2)
(2)
отражает стремление системы перейти от более упорядоченного состояния к менее упорядоченному, т.е., от менее вероятного к более вероятному. Значение энтропии тем выше и тем вероятнее характеризуемое ею состояние, чем большим числом микросостояний может быть представлена система. Для неупорядоченной хаотичной системы таких микросостояний огромное множество, поскольку неупорядоченность предполагает огромное количество комбинаций взаимного расположения частиц. Поэтому такая система более вероятна и характеризуется большим положительным значением энтропии. Если же система упорядочена, высокоструктурирована, то находящиеся во взаимном расположении частицы обычно жестко связаны между собой силами химического или межмолекулярного взаимодействия, не имеют достаточно степеней свободы для движения друг относительно друга с образованием новых комбинаций взаимного расположения. Поэтому число микросостояний такой системы невелико, и последняя характеризуется низким значением энтропии. Исходя из изложенного, самопроизвольность процесса определяет положительное значение изменения энтропии:  и
и  .
.
Энтальпийный фактор, характеризующий тенденцию перехода системы из более высокого энергетического состояния к менее высокому, выражается изменением энтальпии системы при переходе из одного состояния к другому:
 (3)
(3)
Суммарный вклад обоих факторов отражается в выражении изменения изобарно-изотермического потенциала:
 (4)
(4)
Поскольку самопроизвольность процесса определяется неравенством  , можно видеть, что этому способствуют положительное изменение энтропии процесса
, можно видеть, что этому способствуют положительное изменение энтропии процесса  (переход системы из более упорядоченного к менее упорядоченному состоянию) и отрицательное изменение энтальпии процесса
(переход системы из более упорядоченного к менее упорядоченному состоянию) и отрицательное изменение энтальпии процесса  (переход системы из более высокого энергетического состояния к менее высокому).
(переход системы из более высокого энергетического состояния к менее высокому).
В общем случае значение 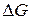 определяется совместным вкладом обоих факторов. В этом плане можно выделить 4 случая.
определяется совместным вкладом обоих факторов. В этом плане можно выделить 4 случая.
1)  ,
,  . В этом случае процесс осуществим при любой температуре.
. В этом случае процесс осуществим при любой температуре.
2)  ,
,  . В этом случае процесс термодинамически запрещен (
. В этом случае процесс термодинамически запрещен ( 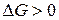 ) во всем диапазоне условий (самопроизвольно будет протекать обратный процесс).
) во всем диапазоне условий (самопроизвольно будет протекать обратный процесс).
3)  ,
,  . В этом случае самопроизвольность процесса определяется балансом двух факторов. Самопроизвольному процессу соответствует условие
. В этом случае самопроизвольность процесса определяется балансом двух факторов. Самопроизвольному процессу соответствует условие 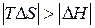 , которому отвечает диапазон температур
, которому отвечает диапазон температур 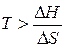 . Можно видеть, что такая ситуация реализуется в области высоких температур, нижний предел которых определяется значением
. Можно видеть, что такая ситуация реализуется в области высоких температур, нижний предел которых определяется значением 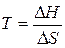 .
.
4)  ,
,  . Как и в предыдущем случае, самопроизвольность процесса определяется балансом энтропийного и энтальпийного факторов. В частности, в соответствии с требованием
. Как и в предыдущем случае, самопроизвольность процесса определяется балансом энтропийного и энтальпийного факторов. В частности, в соответствии с требованием  самопроизвольный характер процесса определяется неравенством
самопроизвольный характер процесса определяется неравенством  , которому отвечает диапазон температур
, которому отвечает диапазон температур 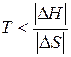 . Такая ситуация реализуется в области низких температур, верхний предел которых определяется значением
. Такая ситуация реализуется в области низких температур, верхний предел которых определяется значением 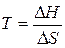 .
.
Из положений (1), (2), (3)) следует, что значения 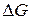 ,
,  и
и 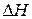 определяются конечным и начальным состоянием системы. Это открывает возможность их определения на основе данных, характеризующих начальное и конечное состояния систем. Для химической реакции
определяются конечным и начальным состоянием системы. Это открывает возможность их определения на основе данных, характеризующих начальное и конечное состояния систем. Для химической реакции
 (5)
(5)
изменение энтропии в стандартных условиях (298К, 101,3кПа) определяется равенством:
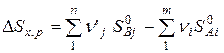 (6)
(6)
где  и
и 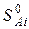 – энтропии j-го и i-го реагента соответственно в стандартных условиях.
– энтропии j-го и i-го реагента соответственно в стандартных условиях.
Значения энтропий различных простых и сложных веществ табулированы в соответствующих справочниках.
Энтальпия процесса (изменение Н) для реакции (5) определяется выражением:
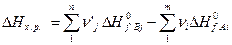 (7)
(7)
где  и
и 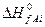 – теплоты образования j-го продукта и i-го реагента из простых веществ в стандартных условиях.
– теплоты образования j-го продукта и i-го реагента из простых веществ в стандартных условиях.
Изменение изобарно-изотермического потенциала для реакции (5) определяется выражением:
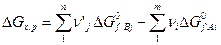 (8)
(8)
где 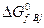 и
и  – изменения изобарно-изотермических потенциалов при образовании продуктов реакции и реагентов из простых веществ в стандартных условиях.
– изменения изобарно-изотермических потенциалов при образовании продуктов реакции и реагентов из простых веществ в стандартных условиях.
Очевидно, что движущая сила процесса (  ) может быть рассчитана по формуле (8), если есть прямые данные по
) может быть рассчитана по формуле (8), если есть прямые данные по 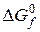 . Если же такие данные отсутствуют, то сначала рассчитываются
. Если же такие данные отсутствуют, то сначала рассчитываются  и
и  , а затем по уравнению (4) определяют
, а затем по уравнению (4) определяют  .
.
Значения 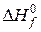 и
и 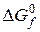 различных сложных веществ приведены в соответствующих справочниках.
различных сложных веществ приведены в соответствующих справочниках. 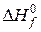 и
и 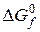 простых веществ равны нулю.
простых веществ равны нулю.
Раздел термодинамики, изучающий тепловые эффекты химических реакций и способы их расчета, называется термохимией.
Теплота химической реакции влияет на энергетическое состояние системы и может иметь важное значение при выборе условий протекания той или иной реакции. Как будет показано ниже, при постоянстве температуры и давления теплота реакции равна энтальпии процесса 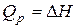 и, таким образом, отражает вклад энергетического фактора в изменение изобарно-изотермического потенциала.
и, таким образом, отражает вклад энергетического фактора в изменение изобарно-изотермического потенциала.
В соответствии с законом сохранения энергии (первый закон термодинамики) теплота, полученная системой, идет на изменение ее внутренней энергии  и на совершение работы А:
и на совершение работы А:
 (9)
(9)
Как G и H, внутренняя энергия является функцией состояния системы, и поэтому ее изменение определяется конечным и начальным состоянием:
 (10)
(10)
Теплота и работа не являются функциями состояния, так как они являются формами передачи энергии и связаны с процессом, а не с состоянием системы.
В химических реакциях А – работа против внешнего давления, т.е. в первом приближении 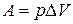 , где
, где  – изменение объема системы
– изменение объема системы 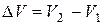 .
.
Так как большинство химических реакций протекает при постоянном давлении, то для изобарно-изотермического процесса ( 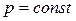 ,
,  ), теплота реакции будет равна
), теплота реакции будет равна
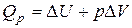
| |
| или | 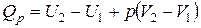
|
| и | 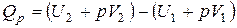 (11) (11)
|
Сумма  называется энтальпией процесса (Н). Из выражения (11) следует, что теплота процесса в условиях постоянства температуры и давления приобретает свойства функции состояния, т.е. не зависит от пути, по которому протекает процесс, и равна изменению энтальпии системы
называется энтальпией процесса (Н). Из выражения (11) следует, что теплота процесса в условиях постоянства температуры и давления приобретает свойства функции состояния, т.е. не зависит от пути, по которому протекает процесс, и равна изменению энтальпии системы
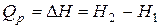
Таким образом, энтальпия является функцией состояния, поскольку ее изменение определяется только начальным и конечным состоянием системы. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V = const,  ), при котором
), при котором  , равна изменению внутренней энергии системы:
, равна изменению внутренней энергии системы:
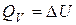 (12)
(12)
Теплоты химических процессов, протекающих при 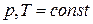 и
и 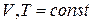 , называются тепловыми эффектами.
, называются тепловыми эффектами.
Расчеты тепловых эффектов основаны на следствии из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов перед формулами этих веществ в уравнении реакции.
Количественно расчет тепловых эффектов химических реакций представляется формулой (7). Особенностями расчетов по этому уравнению являются:
– в уравнении (7) значение  соответствует тому агрегатному состоянию, в котором реагент или продукт реакции входит в стехиометрическое уравнение (5);
соответствует тому агрегатному состоянию, в котором реагент или продукт реакции входит в стехиометрическое уравнение (5);
– коэффициенты уравнения (7) могут быть дробными, если требуется определить тепловой эффект на моль одного из продуктов реакции или реагентов.
В соответствии с законом Гесса тепловой эффект сложного процесса равен сумме тепловых эффектов его стадий. Так, образование оксида углерода (IV) из графита и кислорода можно рассматривать как результат непосредственного взаимодействия простых веществ
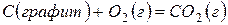 ,
, 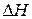 (13)
(13)
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II)
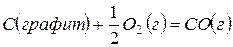 ,
, 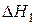 (14)
(14)
| <== предыдущая страница | | | следующая страница ==> |
| Примеры решения типовых задач 3 страница | | | Примеры решения типовых задач 5 страница |
Дата добавления: 2014-10-14; просмотров: 445; Нарушение авторских прав

Мы поможем в написании ваших работ!