
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Ферментные системы антиоксидантной защиты
В настоящее время известны следующие ферментные системы: 1) супероксидисмутаза + каталаза, 2) глутатионпероксидаза + глутатионредуктаза, 3) глутатион-S-транфераза + глутатионредуктаза.
Супероксиддисмутаза (СОД).Супероксиддисмутаза – ключевой фермент, лимитирующий скорость всего цикла превращений супероксидного анион-радикала в другие активные формы кислорода и контролирующий тем самым скорость перекисного окисления липидов.
СОД осуществляет инактивацию супероксидных анионов кислорода. Фермент обнаружен во всех аэробных организмах. Все виды СОД содержат в активном центре либо медь и цинк, либо марганец. В цитозоле клеток человека находится Cu2+/Zn+ -СОД, в митохондриях – Mn2+-СОД.
Под действием СОД осуществляется реакция диспропорционирования свободных радикалов кислорода (супероксидных анионов) в присутствии протонов:
1. E-Cu2+ + O2-* E-Сu+ + O2
2. E-Cu+ + O2-* + 2H+ Е-Cu2+ + H2O2
Суммарно: О2-* + О2-* СОД + 2Н+ О2 + Н2О2
Как уже было отмечено, СОДчрезвычайно распространена среди живых организмов. Особенно активна СОД в фагоцитирующих клетках, в которых АФК генерируются в качестве бактерицидных факторов. СОД в данном случае выполняет роль регулятора, обеспечивающего выполнение биологических функций свободных радикалов кислорода на уровне, не превышающим порог безопасности для клетки. Издержками этого ферментативного процесса является образование перекиси водорода, способной образовывать высокореакционные гидроксильные радикалы. Особая опасность перекиси водорода заключается в том, что ее молекула небольших размеров, лишена заряда и может, в отличие от супероксидного анионрадикала, легко диффундировать на большие расстояния, что представляет серьезную опасность для жизненноважных структурных элементов клетки. Однако в клетках перекись водорода быстро обезвреживается с помощью другого фермента – каталазы.
Последнее обстоятельство препятствует распространению перекиси водорода после ее локального образования в результате действия СОД.
Каталаза. Каталаза - один из самых мощных ферментов известных в настоящее время. Одна молекула каталазы способна обеспечить разложение 44 000 молекул Н2О2 в 1 сек. Каталаза обнаружена во всех клетках животного организма. Особенно в больших количествах каталаза содержится в эритроцитах и в печени. Каталазная реакция довольно сложна в химическом отношении, схематически ее можно представить следующим образом:
НООН + НООН каталаза 2 Н2О + О2
В каталазной реакции донором и акцептором электронов служат сами молекулы перекиси водорода, продуктами реакции являются вода и молекулярный кислород.
Каталаза в клетках, в частности, в эритроцитах находится в едином комплексе с СОД, поэтому совместное действие этих антиоксидантных ферментов может быть представлено в виде единой реакции:
O2-* + 2H+ СОД H2O2 каталазаН2О + О2
Таким образом, совместное действие супероксидисмутазы и каталазы обеспечивает надежную защиту организма от токсического действия высоких концентраций супероксидного анион-радикала и перекиси водорода, но, в то же время, поддерживает минимальный (ниже 50,0 мкМ) контролируемый уровень этих соединений необходимых в физиологических условиях для осуществления многих клеточных процессов. Так, установлено, что перекись водорода в диапазоне концентраций 20-25 мкМ является стимулятором клеточной активности.
Исследованиями последних лет показано, что перекись водорода (0,1 – 50,0 мкМ) активирует калиевые каналы плазматической мембраны, дозозависимо усиливает оксилительный взрыв нейтрофилов и макрофагов в ответ на хемотактический пептид, опосредует хемотаксис гладкомышечных клеток к тромбоцитарному фактору роста, ускоряет выход органических анионов из макрофагов, влияет на циклооксигеназную активность эпителиальных клеток и тромбоцитов, усиливает секрецию простагландинов из эндотелиальных клеток, усиливает фагоцитоз макрофагами частиц опсонизированноголатекса, участвует в образовании тиреоидных гормонов и агрегации тромбоцитов, стимулирует выброс гистамина их тучных клеток, адгезию лейкоцитов к эндотелию и эндоцитоз эндотелиальных клеток. Кроме этого, установлено, что перекись водорода в малых дозах вызывает гидролиз инозитолфосфолипидов с последующей активацией протеинкиназы С, активирует различные фосфолипазы.
Таким образом, комлекс СОД+каталаза обеспечивает и образование перекиси водорода и поддержание ее концентрации на уровне, обеспечивающим участие в клеточных процессах. В случае необходимости изменение активности одного из ферментов может резко изменить и уровень перекиси водорода. Так, например, при стимуляции фагоцитоза резко возрастает активность СОД, что приводит к образованию повышенных количеств перекиси водорода, которая используется для создания самых мощных деструктивных факторов фагоцитоза – гидроксильного радикала и гипохлорит-иона.
Глутатионпероксидазная система. Обязательным кофактором этой системы является глутатион. Глутатион – один из наиболее распространенных пептидов в растительном и животном мире. Он содержится практически во всех клетках и особенно в больших количествах в ткани мозга, печени, почках, эритроцитах.
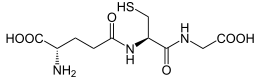
Рис.9. Структурная формула глутатиона
По своей структуре глутатион представляет собой трипептид, состоящий из глутаминовой кислоты, цистеина и глицина. Особенностью глутатиона является то, что глутаминовая кислота образует пептидную связь своей гамма- , а не альфа-карбоксильной группой (гамма-глутаминил-цистеинил-глицин):
Функциональной особенностью глутатиона является его участие в окислительно-восстановительных реакциях, что обусловлено наличием SH-группы, которая обратимо легко отдает или присоединяет ион водорода (протон).
Глутатионпероксидаза (ГПО) содержится во всех исследованных животных организмах и локализована, в основном, в растворимой фракции клеток, на долю митохондрий приходится всего около 25% общей активности этого фермента в клетке.
ГПО является тетрамером, состоящим из идентичных субъединиц, каждая из которых содетжит по одному атому селена. Полагают, что антиоксидантные свойства селена и селенсодержащих соединений реализуются в организме,главным образом, благодаря включению селена в ГПО-катализ. Каталитическую функцию селена в организме подтверждает чрезвычайно низкая (но абсолютно обязательная) потребность, составляющая всего лишь микро- и даже нанограммы в сутки. При недостатке селена в питании уменьшается уровень активности ГПО, что сопровождается снижением устойчивости организма к окислительному поражению и может приводить к развитию свободнорадикальной патологии, характеризующейся разрушением эритроцитов, некрозом и ожирением печени.
ГПО катализирует реакцию восстановления глутатионом органических гидроперекисей, превращая их в стабильные оксикислоты:
ROOH + 2 G-SH ГПО ROH + G-S-S-G
Продукты восстановления – оксикислоты могут метаболизироваться дальше, а окисленный глутатион (G-S-S-G) восстанавливается в глутатионредуктазной реакции с участием NADPH:
G-S-S-G + NADPH + Н+2 G-SH + NADP
Глутатионпереоксидаза не обладает абсолютной специфичностью и способна восстанавливать не только гидроперекиси полиненасыщенных жирных кислот, но и перекисиь водорода и другие пероксиды, включая пероксинитрит. Но тетрамерные формы ГПО не способны восстанавливать гидропероксигруппы в структуре фосфолипидов. Они могут превращать окисленные остатки полиненасыщенных жирных кислот в оксикислоты только после их отщепления в результате гидролиза фосфолипазой А2
Существенным является то обстоятельство, что при действии ГПО в отличие от геминового катализа или катализа ионами металлов переменной валентности свободные радикалы не образуются.
В клетках млекопитающих обнаружен изофермент ГПО, названный «ГПО гидроперекисей фосфолипидов», представляющий собой мономер, содержащий только один атом селена. Этот изофермент кроме гидроперекисей жирных кислот и перекиси водорода, способен восстанавливать гидроперекисные остатки полиненасыщенных жирных кислот в структуре фосфолипидов. Фермент обладает липофильными свойствами, поэтому, находясь в липидной среде клеточных мембран, он эффективно взаимодействует с гидроперекисями фосфатидилхолина, холестерина и эфиров холестерина. Кроме этого восстановлению подвергаются и гидроперекиси, содержащиеся в липопротеидах низкой плотности.
Глутатион-S-трансферазная система.
Известен еще один фермент, использующий G-SН для восстановления гидроперекисей жирных кислот, - глутатион-S-трансфераза (ГТ). В отличие от ГПО ГТ не способна восстанавливать перекись водорода, но подобно мономерной ГПО весьма эффективно восстанавливает гидропероксиацилы мембранных фосфолипидов, а также подобно тетрамерной ГПО восстанавливает свободные гидроперекиси полиненасыщенных жирных кислот, образовавшиеся в результате гидролиза окисленных фосфолипидов фосфолипазой А2. Восстановление гидроперекисей полиеновых жирных кислот как свободных, так и находящихся в структуре мембранных фосфолипидов протекает по схеме:
ROOH + G-SH ГТ ROH + G-SOH
Нестойкое сульфеновое производное глутатиона (G-SOH) способно взаимодействовать еще с одной молекулой глутатитона с образование дисульфида окисленного глутатиона:
G-SOH + G-SHG-S-S-Н + H2O, далее действует глутатионредуктаза.
ГТ не конкурентна в своих действиях ГПО. Полагают, что в нормальных физиологических условиях, когда фосфолипаза А2 малоактивна, контроль за уровнем липопероксидов в клетке осуществляется преимущественно ГТ, способной напрямую восстанавливать мембранные фосфолипиды. В условиях патологии, когда вследствие ацидоза и повышения уровня внутриклеточного Са2+ активируется фосфолипаза А2 и отщепляются свободные гидроперекиси полиеновых жирных кислот, действует «классическая» тетрамерная ГПО. Таким образом, глутатионзависимые антиоксидантные ферменты – ГПО и ГТ играют важную роль в репарации мембранных структур после их свободнорадикального повреждения. Кроме этого, установлено, что ГТ также способствует конъюгированию с G-SH токсичных конечных продуктов ПОЛ, что способствует их выведению из организма.
Структурный антиоксидантный фактор.
Важным неспецифическим фактором регуляции ПОЛ, действующим практически на всех стадиях процесса свободнорадикального окисления является, так называемый, структурный антиоксидантный фактор, под которым понимается комплекс свойств биологических мембран, ограничивающий доступ молекул кислорода, его активных форм, а также радикальных интермедиатов и катализаторов ПОЛ к полиеновым жирным кислотам, входящих в структуру мембранных фосфолипидов. Доказательством роли структурного антиоксидантного фактора является резкое увеличение скорости ПОЛ при действии на мембраны хаотропных агентов, нарушающих упорядоченную структуру липидных и белковых компонентов мембраны и увеличивающих их молекулярную подвижность. Некоторые антиоксиданты (токоферол, стероиды, эйкозаноиды) кроме непосредственной способности нейтрализовывать свободные радикалы, стабилизируют липопротеидные комлексы, являющиеся основой биологических мембран.
В последние годы активно развивается представление о том, что углекислый газ – диоксид углерода (СО2) является мощным природным ингибитором активных форм кислорода фагоцитами (А.Х.Коган с соавт.,2006). Диоксидуглерода не является как оксид азота и АФК, медиатором патологических процессов и не оказывает в отличие от них цитотоксического действия, приводящего к гибели клетки. Более того, СО2снижает уровень провоспалительных цитокинов – альфа-ФНО и интерлейкина-6 в плазме крови. Диоксид углерода непрерывно образуется при обмене веществ в тканях всех органов, в то время как синтез оксида азота и образование АФК – процесс строго контролируемый. Диоксид углерода, снижая концентрацию супероксидного анион-радикала способствует уменьшению взаимодействия последнего с оксидом азота и образованием пероксинитрита – одного из самых мощных оксидантов. Снижение концентрации АФК, оксида азота и пероксинитрита уменьшает их токсическое действие, при этом возрастает роль этих соединений в регуляции физиологических процессов.
На рис.14представлена обобщенная схема действия антиоксидантных факторов на отдельных этапах процессов ПОЛ в организме.
Таким образом, организм обладает мощной многоуровневой системой регуляции свободнорадикального окисления, обеспечивающей контроль всего процесса в целом - от момента зарождения свободнорадикальных форм кислорода до образования продуктов ПОЛ. Это обеспечивает надежную защиту организма от свободнорадикальных повреждений и в то же время делает возможным использование свободнорадикальных реакций для осуществления жизненноважных процессов в организме. В сложной антиоксиданой системе организма условно можно выделить четыре главных звена:
1. - антиоксидантные ферменты (СОД, каталаза, пероксидазы, глутатионпреоксидаза)
2. - низкомолекулярные антиоксиданты, синтезируемые в организме (глутатион, мочевая кислота, аминокислоты, содержащие сульфгидрильную группу - цистеин, цистин и др., низкомолекулярные белки, среди которых особое место занимают металлотионеины, содержащие до 30% цистеина (в составе этих белков цистеин в 770 раз более эффективен, чем цистеин в составе глутатиона

Рис.10. Основные пути образования и утилизации свободных радикалов (по Ланкину В.З. с соавт., 2001): 02*- -супероксиднй анион-радикал, НО* - гидроксильный радикал, НО2*- гидроперексиный радикал, Н2О2 – перекись водорода, L*- алкильный липидный радикал, LO2*- гидроперексиный липидный радикал, LOOH – липидная гидроперекись, LO*- алкоксильный липидный радикал, LOH – гидроксипроизводное липида, продукт ферментативного восстановления LOOH, GSH- восстановленный глутатион, GSSG- исленный глутатион, α-ТОН – альфа-токоферол, α-ТО*- феноксильный радикал альфа-токоферола, QH2 – восстановленная форма убихинона Q10(убихинол), *QH- семихинонный радикал, HO-Asc-OH- аскорбиновая кислота, HO-Asc-O*- радикал аскорбиновой кислоты (семидегидроаскорбат).
3. - природные антиоксиданты, поступающие в организм с пищей (аскорбиновая кислота, токоферол, рутин – витамин Р и другие флавоноиды, каротиноиды – предшественники витамина А и др. витамины и их предшественники. В эту же группу веществ могут быть отнесены химические элементы, входящие в состав активных центров антиоксидантных ферментов – селен, четыре атома которого входят в состав глутатионпероксидазы, цинк, марганец и медь, входящие в состав различных супероксиддисмутаз и др.
4. - специфические белки и пептиды, связывающие ионы металлов переменной валентности, катализирующие реакции свободнорадикального окисления и образования АФК (ферритин – в клетках, трансферрин – в плазме крови, церулоплазмин в плазме крови, карнозин в мышечных клетках и др.).
Ослабление антиоксидантной защиты, обусловленное самыми различными причинами, либо связанными с нарушением деятельности самих антиоксидантных факторов, либо повышением активности проксидантов и резкой интенсификацией свободнорадикальных реакций, приводящей к образованию свободнорадикальных продуктов в количестве, превосходящем возможности антирадикальной системы, всегда представляют серъезную опасность для организма. Выход свободнорадикального окисления на неуправляемый уровень неизбежно приводит к повреждению биологических мембран, нарушению их функций и в конечном итоге – к гибели всего организма
ПРОСТАГЛАНДИНЫ (PG)
ПG - биологически активные липиды, представляющие собой производные простановой к-ты (ф-ла I) и различающиеся положением заместителей и двойных связей в циклопентановом кольце и боковых цепях. Простановая кислота, в свою очередь, является производной арахидоновой кислоты.
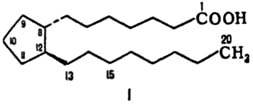
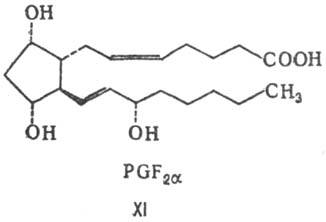
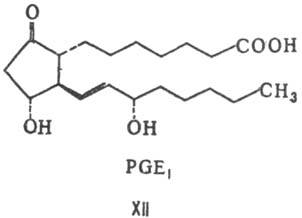
Молекулы простагландинов имеют скелет из 20 атомов С и содержат обычно в положении 15 гидроксигруппу. В зависимости от строения цикла и характера боковых групп в нем различают простагландины типов А, В, С, D, Е, F, H, I и J (типы колец приведены в формулахII-X; простагландины G, или PGG, отличаются от PGH наличием в положении 15 группы -ООН вместо группы -ОН). Цифры в нижнем индексе букв обозначают количестводвойных связей в боковых цепях (у простагландинов типа F иногда в нижнем индексе ставится также греч.буква a или b, указывающая на ориентацию группы ОН в положении 9 относительно плоскости цикла (соответственно за или перед плоскостью цикла) (см., формулы соединений. РGF2a (XI) и PGE1 (XII).
Простагландины и их производные обнаружены практически во всех клетках млекопитающих [впервые выделены из пузырьковидной (везикулярной) простатической железы]. Их содержание в большинстве тканей невелико (несколько мкг/г и менее).
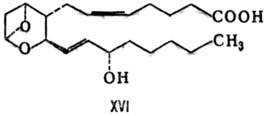
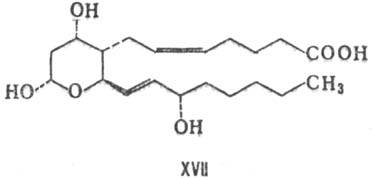
Индивидуальные простагландины-кристаллы или вязкие жидкости, плохо растворимые в воде. Свободные эйкозаполиеновые кислоты окисляются кислородом в присутствии комплекса ферментов. Вначале циклооксигеназа катализирует стереоспецифическое присоединение пероксидных радикалов в положения 11 и 15 с последующим образованием пероксидного мостика и циклопентанового кольца; образовавшийся PGG восстанавливается пероксидазой до более стабильного PGH - исходного соединения для биосинтеза простагландинов остальных типов.
Свободная арахидоновая кислота (эндогенная фосфолипидов или экзогенная) окисляется кислородом в присутствии комплекса ферментов. Синтез простагландинов осуществляется в два этапа: окисление под действием циклоксигеназы и конечной простагландинсинтазы. Центральным химическим процессом биосинтеза является включения молекулярного кислорода (двух молекул) в структуру арахидоновой кислоты, осуществляемое специфическими циклооксигеназами, которые, помимо окисления, катализируют и циклизацию с образованием промежуточных продуктов простагландин-эндоперекисей ПГ G2.
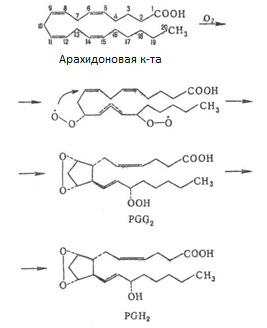
Рис.11. Биосинтез простагландинов.
В эту группу входят и соединения со сходным химическим строением — лейкотриены и тромбоксаны. Первые участвуют в аллергических и воспалительных процессах, а вторые играют заметную роль в работе свертывающей системы крови.
В ряде клеток из PGH2 образуется тромбоксан (ТХ) типа А2- очень нестабильное бициклическое соединение с высокой биологической активностью.
Все простагландины быстро инактивируются в организме и поэтому их концентрация в плазме крови мала (напр., 40-50 пикограмм для PGE), тогда как количество неактивных метаболитов, выделенных с мочой, может достигать 330 мкг в сутки. Катаболизм простагландинов начинается с их окисления НАД-зависимой 15-оксипростагландиндегидрогеназой, обнаруженной в цитозоле клеток млекопитающих (наибольшую активность фермент проявляет в тканях легких, плаценты, печени, почек). Простагландины обладают разнообразной физиологической активностью в низких концентрациях (10-9 М и менее), например PGE1:
1. Участвуют в поддержании гомеостаза.
2. Воздействуя на специфические рецепторы формируют ощущении боли
3. Участвуют в регуляции иммунного ответа.
Простагландины PGE2:
1. Инициирует родовую деятельность
2. Ингибирует роды
3. Стимулирует синтез соляной кислоты, выработку слизи в ЖКТ, проявляя противоязвенный эффект
4. Вызывают расширение бронхов и трахеи
5. Усиливают воспалительную реакцию и т.п.
6. Снижают артериальное давление
Простагландины PGF2a:
1. Стимулируют роды.
2. Снижают секрецию прогестерона, необходимого для имплантации в матке оплодотворенной яйцеклетки.
3. Поддерживают в расширенном состоянии грудной проток плода.
4. Повышают кровяное давление
5. Вызывают сокращение бронхов и трахеи
Кроме того, простагландины обусловливают повышение температуры тела, оказывают седативное и транквилизирующее действие, стимулируют секрециюферментов поджелудочной железой, тормозят желудочную секрецию, способны опосредовать и модулировать действие другихбиологических стимулов. Простагландины разных типов могут действовать как синергисты или антагонисты. Так, баланс между уровнем простациклина PGI2 (ингибирует агрегацию тромбоцитов, расширяет артерии) и тромбоцитарным ТХА2 (индуцирует агрегацию тромбоцитов, суживает артерии) - важный компонент гемостаза (поддерживает постоянный состав крови). Простагландины типов A, J и D оказывают противовирусное действие, а простагландины типов J, D и их А -производные проявляют высокую противоопухолевую активность. Вследствие чрезвычайно быстрого распада в организме простагландины действуют, в отличие от гормонов, вблизи места секреции.
Механизмы физиологического действия простагландинов разнообразны. Простагландины взаимодействуют со специфическими рецепторами цитоплазматических мембран, что приводит к изменению (увеличению или уменьшению) концентрации внутриклеточных циклических нуклеотидов (напр., цАМФ), способны проникать через мембраны (включая гематоэнцефалический барьер) и связываться с внутриклеточными компонентами, влияя, на синтез ДНК, индуцируют перенос катионов через мембраны, изменяя физиологическое состояние клеток.
Простациклин (ПГI2)синтезируется в эндотелии сосудов, сердечной мышце, ткани матки и слизистой оболочке желудка. Он расслабляет, в противоположность тромбоксану, гладкую мускулатуру сосудов и вызывает дезагрегацию тромбоцитов, способствуя фибринолизу.
Следует отметить особое значение соотношения тромбоксаны: простациклины, в частности ТхА2/ ПГ I2 для физиологического статуса организма. Оказалось, что у больных, предрасположенных к тромбозам, имеется тенденция к смещению баланса в сторону агрегации; у больных, страдающих уремией, напротив, наблюдается дезагрегация тромбоцитов.
Выдвинуто предположение о важности соотношения ТхА2 / ПГ I2 для регуляции функции тромбоцитов invivo, сердечно-сосудистого гомеостаза и т.д.
Сейчас уже установлено, что усиление синтеза ПГ F2 и понижение концентрации ПГ Е2 приводят к возникновению разных форм бронхиальной астмы, изменение уровня этих простагландинов зафиксировано у больных пневмонией и бронхитом.
В плазме и сыворотке крови обычно содержатся все природные простагландины и (или) продукты их превращений. Однако все они попадают в кровь из других органов.
В самой же кровеносной системе синтезируются простациклин и тромбоксан, по своему действию эти вещества являются антагонистами. Синтезируемый в эндотелиальных клетках сосудистых стенок простациклин предотвращает прилипание тромбоцитов к стенкам и образование тромбов, а тромбоксан, синтезируемый тромбоцитами, наоборот, способствует их слипанию, агрегации, т.е. процессам, которые обеспечивают прекращение кровотечений,
ЛЕЙКОТРИЕНЫ
Лейкотриены — группа липидных высокоактивных веществ, образующаяся в организме из арахидоновой кислоты, содержащей 20-членную углеродную цепь и четыре двойные связи. Подкласс лейкотриенов, вместе с простаноидами, входит в класс эйкозаноидов. Один из основных эффектов лейкотриенов — бронхоспазм — лежит в основе патогенеза бронхиальной астмы. Впервые эти соединения были выделены из лейкоцитов и характеризовались наличием конъюгированной триеновой структуры. В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).В настоящее время идентифицированы ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТE4, ЛТF4. По химическому строению, можно выделить две группы лейкотриенов:1–я группа — «пептидные (цистеиновые) лейкотриены», к ним относят ЛТС4, ЛТD4, ЛТЕ4, ЛТF4; 2-я группа — лейкотриены без пептидов: ЛТА4, ЛТВ4. Лейкотриены образуются из арахидоновой кислоты, которая, в свою очередь, отщепляется от фосфолипидов цитоплазматической мембраны с помощью фермента фосфолипазы A2.
Синтез лейкотриенов в основном происходит при аллергических реакциях немедленного типа и начинается после связывания антигена с IgE , фиксированным на поверхности клеток. При этом свободная арахидоновая кислота под действием 5-липоксигеназы превращается в лейкотриен A4 , из которого затем под действием лейкотриен А-гидролазы образуется лейкотриен В4 . При конъюгации лейкотриена В4 с глутатионом образуется лейкотриен С4 . В дальнейшем лейкотриен С4 превращается в лейкотриен D4 , из которого, в свою очередь, под действием пептидазы образуется лейкотриен Е4.
Лейкотриен В4 - первый стабильный продукт липоксигеназного пути метаболизма арахидоновой кислоты. Он вырабатывается тучными клетками, базофилами, нейтрофилами, лимфоцитами и моноцитами. Это основной фактор активации и хемотаксиса лейкоцитов в аллергических реакциях немедленного типа.
Липоксигеназная ферментная система, катализирующая образование ЛТ, относится к растворимым цитозольным ферментам, она обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным среди ферментов этой системы является 5-липоксигенеза (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА4. Обе эти реакции катализируются активированной 5-ЛОГ, расположенной на перинуклеарной мембране.
Известно 6 типов лейкотриенов — А, В, С, D, Е и F. Их объединяет — с точки зрения химического строения — наличие карбоксильной группы, общее число атомов углерода в основной цепочке (20) и наличие 4 двойных связей (поэтому после написания названия лейкотриена, указывают индекс 4.
ЛТC4, ЛТD4, ЛТE4 являются основными компонентами МРСА, поэтому, в первую очередь, эта группа лейкотриенов относится к мощным бронхоконстрикторам. Также эти лейкотриены способны повышать тонус гладких мышц ЖКТ, опосредовать экссудацию плазмы и сокращение паренхимы лёгких.
Лейкотриены участвуют в патогенезе бронхиальной астмы. Вместе с гистамином лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа. В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм.
ФОСФОЛИПИДЫ МЕМБРАН
фосфолипаза А2
Х стероиды
АРАХИДОНОВАЯ КИСЛОТА
ПГ-синтетаза 5-липоксигеназа
аспиринХ
ПРОСТАГЛАНДИНЫ ЛЕЙКОТРИЕНЫ
Н2 А4
Е2 F 2 I2А 2 C4 → D4 → E4
Рис.12. Механизм развития аспирин-индуцированного бронхоспазма
Лейкотриены опосредуют развитие, так называемого, аспиринового бронхоспазма, возникающий при приёме неселективных нестероидных противовоспалительных средств: аспирина, индометацина и др. Аспириновый бронхоспазм порождается следующим образом. Как уже было отмечено, арахидоновая кислота может трансформироваться двумя путями: под влиянием циклооксигеназы она превращается в простаноиды, а под влиянием липоксигеназной ферментной системы в лейкотриены. Циклоксигеназа, которую ингибируют нестероидные противовоспалительные средства, катализирует реакцию превращения арахидоновой кислоты в циклический эндопероксид ПГ H2. Вследствие ингибирования циклооксигеназы синтез ПГ резко уменьшается, и на этом фоне преобладающими становятся лейкотриены.
Однако, активность фосфолипазы A2остаётся неизменной, соответственно арахидоновой кислоты отщепляется от фосфолипидов цитоплазматической мембраны столько же, сколько и в норме. Но, если в физиологических условиях арахидоновая кислота равномерно распределялась, поступая на синтез и ПГ и ЛТ, то при ингибировании ЦОГ, она целиком и полностью поступает на синтез лейкотриенов.
Таким образом, при использовании неселективных нестероидных противовоспалительных средств, в тканях человека будет не просто преобладание ЛТ, но они будут синтезироваться интенсивнее, чем в норме. ЛТC4, ЛТD4, ЛТE4 входят в комплекс МРСА, которая порождает бронхоспазм.
Лейкотриены С4 и D4 являются активными контрактильными агентами гладкой мускулатуры дыхательных путей и сосудов, кроме того, они могут вызывать секрецию слизи и усиливать плазматическую эксудацию прямым воздействием на эндотелиальные клетки. Лейкотриен В4 известен как активный хемокинетический и хемотактильный агент. Эти активные липидные биоэффекторы синтезируются в ходе воспалительных реакций и их фармакологическая модуляция может существенно изменять клиническую картину, ассоциированную с различными воспалительными патологиями.
Лейкотриены С4, D4 и Е4 раньше объединяли под названием «медленно реагирующая субстанция анафилаксии», поскольку их высвобождение приводит к медленно нарастающему стойкому сокращению гладких мышц бронхов и ЖКТ. Ингаляция лейкотриенов С4 , D4 и Е4, как и вдыхание гистамина, приводит к бронхоспазму. Однако лейкотриены вызывают этот эффект в 1000 раз меньшей концентрации. В отличие от гистамина, который действует преимущественно на мелкие бронхи, лейкотриены действуют и на крупные бронхи. Лейкотриены С4, D4 и Е4 стимулируют сокращение гладких мышц бронхов, секрецию слизи и повышают проницаемость сосудов.
СВОБОДНОРАДИКАЛЬНОЕ ОКИСЛЕНИЕ, ФАГОЦИТОЗ И ВОСПАЛЕНИЕ
Под фагоцитозом понимают активное поглощение и разрушение клетками твердых частиц, чуждых для организма. Эти частицы могут быть любой природы: микроорганизмы и вирусы, иммунные комплексы антиген-антитело, простейшие или гельминты, твердые неорганические частицы, попадающие в наш организм в виде пыли и др. Фагоцитозу подвергаются и отмершие клетки и части погибших клеток собственного организма. В любом случае киллерный механизм и последующий механизм деструкции неживых частиц универсален. Фагоциты способны проявлять как цитотоксическое, так и бактерицидное действие. Цитотоксическое действие реализуется экстрацеллюлярными факторами, в то время как бактерицидность обеспечивается, главным образом, внутриклеточными механизмами.
Фагоциты представляют собой клетки с выраженной способностью к фагоцитозу. Для обеспечения резистентности человека особо важное значение имеют полиморфноядерные нейтрофилы, что определяется их количеством и особенностями функции. Полиморфоноядерные нейтрофилы представляют собой основной компонент лейкоцитов крови человека. Ежедневно из костного мозга в кровь выходит примерно 1011 полиморфноядерных нейтрофилов, а при острых инфекциях это количество может возрастать в 10-20 раз, при этом в крови появляются незрелые формы (сдвиг формулы крови влево).
Моноциты периферической крови и, формирующиеся на их основе, тканевые макрофаги образуют, так называемую, «мононуклеарно фагоцитирующую систему – МНС». Основной структурной единицей МНС являются макрофаги – активно фагоцитирующие клетки, содержащие внутриклеточные ферменты для деструкции поглощенного материала и имеющие необходимый аппарат для выработки этих ферментов.
Взаимодействие твердых частиц с поверхностными рецепторами вызывает активацию фагоцитов, заключающуюся в повышении проницаемости цитоплазматической мембраны и перестройке клеточного метаболизма, опосредованной повышением внутриклеточной концентрации ионов кальция, активированием аденилатциклазы и протеинкиназы С. В активированных фагоцитах значительно усиливается окисление глюкозы по гексозо-монофосфатному пути (пентозный цикл) и резко (в десятки раз) усиливается потребление кислорода. Последнее обстоятельство, а также внезапность и скорость, с которой возникают и развиваются эти реакции, послужили основанием для того, чтобы назвать это явление «респираторным» или «дыхательным» взрывом. Это действительно напоминает взрыв, ибо потребление кислорода возрастает уже в первые секунды после стимуляции фагоцита. Следует отметить, что утилизация кислорода не связана с процессами митохондриального окисления, так как не ингибируется цианидами, и направлена, главным образом, на образование активных форм кислорода.
Респираторный взрыв – одно из универсальных проявлений реактивности фагоцитирующих клеток. Основной механизм сводится к активации фагоцитов в результате контакта плазматической мембраны с фагоцитируемым объектом, что стимулирует активность цитоплазматического ферментного комплекса НАДФН-оксидазы, который катализирует перенос электронов с НАДФН на молекулярный кислород с образованием супероксидного анионрадикала. НАДФН-оксидаза представляет собой мультикомпонентную систему, состоящую из мембраносвязанных и цитозольных компонентов (ФАД, цитохром b558, убихинон). Фермент локализован на мембране таким образом, что НАДФН-связывающий центр направлен внутрь клетки, а супероксиданион-связывающий центр расположен на внешней стороне мембраны. В результате молекулярный кислород восстанавливается на внутренней поверхности мембраны, а супероксидный анионрадикал продуцируется либо в среду окружающую фагоцит, либо, если плазматическая мембрана образует фагосому, внутрь фагосомы, содержащей фагоцитированный материал (микроорганизмы). Убыль НАДФН по механизму обратной связи стимулирует пентозный цикл (гексозо-монофосфатный путь) окисления глюкозы, восполняющий фонд НАДФН.
Таким образом, биохимическую основу «респираторного» взрыва составляют два сопряженных механизма: 1) окисление НАДФН с образованием супероксидного анионрадикала; 2) восстановление НАДФ в реакциях пентозного цикла:
1) НАДФН + О2 НАДФН- оксидазаНАДФ + О2∙ + Н+
2) глюкозо-6-фосфат + НАДФ пентозный циклпентозы + НАДФН
В настоящее время доказано, что стимуляция рецепторов фагоцитов приводит к мобилизации связанного с мембранами Ca2+ и увеличением его концентрации в цитоплазме. Мобилизация внутриклеточного кальция является ведущим механизмом в активации НАДФН-оксидазы. Одновременно с мобилизацией внутриклеточного кальция при стимуляции рецепторов происходит включение системы транспорта ионов кальция, расположенной в плазматической мембране.
Важнейшую роль в развитии дыхательного взрыва играет активация протеинкиназы С. Протеинкиназа С может активироваться высокими концентрациями ионов кальция (в отсутствие диацилглицерина), либо - диацилглицерином в присутствии небольших количеств ионов кальция. Протеинкиназа С осуществляет фосфорилирование мембранных белков, что приводит к их активированию, в частности, это относится к НАДФН-оксидазе.
Показано, что в генерации супероксидного анионрадикала определенную роль играет система «ксантин – ксантиноксидаза», которая, преломляясь через аденилатдезаминазную активность, играет компенсаторную роль при дефектах основного гексозомонофосфат-зависимого пути.
Как в среде окружающей фагоцит, так и внутри фагосомы дальнейшее превращение супероксида, примерно, одинаковое. Супероксиданионы дисмутируют с образованием перекиси водорода, дисмутации способствует снижение рН (закисление среды) в очаге воспаления:
О2∙ + О2∙ + 2 Н+ СОД Н2О2 + О2
Перекись водорода далее под влиянием ионов двухвалентного железа (донор электронов) распадается с образованием гидроксильного радикала (НО*) – самой агрессивной из всех активных форм кислорода. Гидроксильный радикал инициирует перекисное окисление липидов бактериальной стенки, обеспечивая тем самым, один из механизмов бактерицидности, в деструктивный процесс вовлекаются не только липиды, но и белки, нуклеиновые кислоты, полисахариды.
Перекись водорода используется также для образования высокотоксичных гипогалоилодов. Эта реакция катализируется, содержащимися в фагоцитирующих клетках, миелопероксидазой (МПО) и пероксидазой эозинофилов (ЭПО), которые различаются по структуре и субстратной специфичности. Так, основным продуктом МПО является НОСl, в то время как ЭПО катализирует преимущественно образование HOBr, HOI, HOSCN.
Перекись водорода используется также для образования высокотоксичных гипогалоилодов. Эта реакция катализируется, содержащимися в фагоцитирующих клетках, миелопероксидазой (МПО) и пероксидазой эозинофилов (ЭПО), которые различаются по структуре и субстратной специфичности
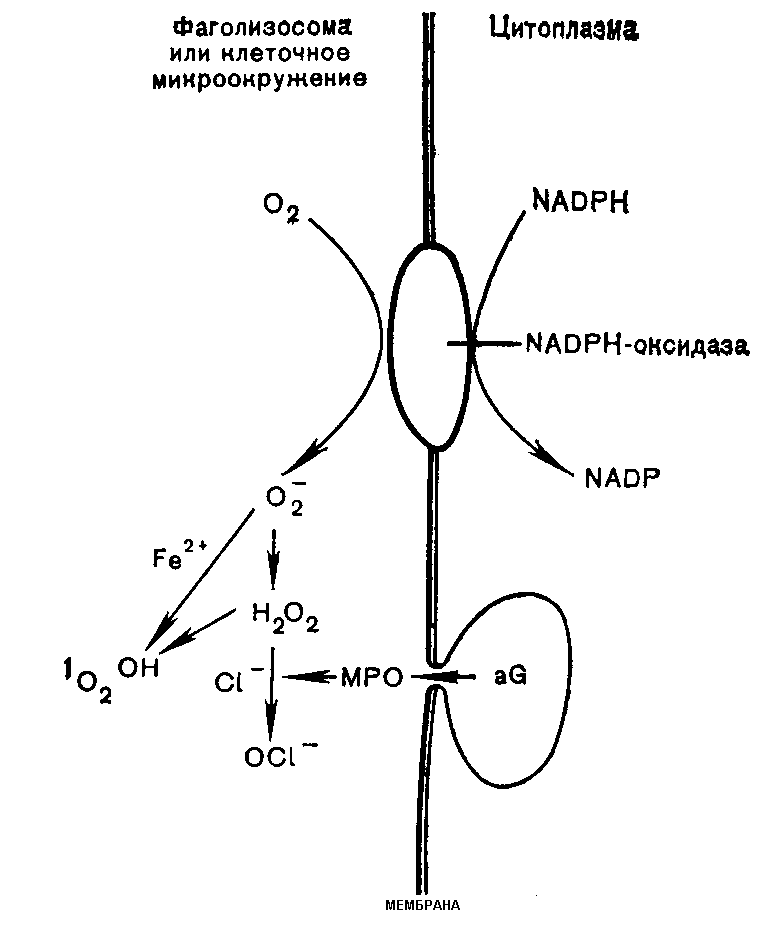
Рис.13. Образование активных форм кислорода в процессе фагоцитоза (МРО-миелопероксидаза, aG – азурофильная гранула)
Так, основным продуктом МПО является НОСl, в то время как ЭПО катализирует преимущественно образование HOBr, HOI, HOSCN.
МПО представляет собой сложный гемопротеин, содержащий две ковалентно связанные железосодержащие простетические группы. Очищенная МПО имеет интенсивный зеленый цвет. Характерный для гнойных выделений зеленоватый оттенок обусловлен, содержащейся в них, МПО. Первичным продуктом окисления миелопероксидазной системой хлоридов является НОCl- гипохлорная (хлорноватистая) кислота:
Н2О2 + Cl- + H+ МПО НОCl + Н2О
Гипогалоиды представляют собой мощные токсины, обладающие чрезвычайной реакционноспособностью в химическом отношении, галогенируя объект либо окисляя его. При взаимодействии с гипогалоидами, в первую очередь, окисляются сульфгидрильные и тиоэфирные группы белков. Гипохлорит может взаимодействовать с биологическими аминами, аминокислотами и белками, продуцируя хлорамины:
НОCl + R-NH2 → RN-HCl + H2O
R – CH – COOH + НОCl → R – CH – COOH + Н2О
| |
NH2 NHCl
Хлорированию подвергаются как свободные аминокислоты, так и аминокислоты, входящие в структуру белковых молекул, с последующим расщеплением, декарбоксилированием и дезаминированием.
Участие свободнорадикального окисления в процессах фагоцитоза и обезвреживания чужеродных частиц может быть представлено в виде нижеследующей схемы (рис.7).
Система МПО ---Н2О2 --- Cl- хлорирует и пептидные связи в белковых молекулах. Этим объясняются детоксицирующий и бактерицидный эффекты. Известно, что хлорная известь и хлорамины издавна используются в качестве дезинфицирующих средств.
Активированные макрофаги и другие фагоцитирующие клетки продуцируют также и оксид азота – NO*. Оксид азота обладает антимикробной, анитивирусной, противопаразитарной и противоопухолевой активностью. При взаимодействии с супероксидным антионрадикалом образуется пероксинитрит, также обладающий высокой токсичностью:
О*2- +NO* → ONOO
Деструкция бактериальных белков в макрофагальной системе усиливается гидролитическим действием тканевых протеаз, активность которых возрастает в результате снятия ингибирующего контроля антипротеаз (альфа-антитрипсин, альфа-макроглобулин и др.). Антипротеазы особенно чувствительны к гипохлорит-ионам и быстро подвергаются окислительной инактивации.
Бактерицидному действию способствует лизоцим, который разрушает полисахариды бактериальной стенки, обеспечивая АФК (гидроксильный радикал, гипохлорит-ион) более свободный доступ к белковым структурам, кроме того, бактериальные полисахариды как многоатомные спирты обладают антиокислительной активностью, поэтому их разрушение усиливает бактерицидный эффект АФК
АКТИВАТОРЫ ФАГОЦИТОВ
(бактерии, вирусы, иммунные комплексы и др.)
активирование
ФАГОЦИТЫ
Активирование пентозного цикла и НАДФН-оксидазы
О*2-
NO*
Н2О2 ONOO
Fe2+ МПОCl-
антипротеазы
НО* Х ОСl-
протеазы
бактерии и др. активаторы
продукты деструкции белков, липидов
(хемоатрактанты)
Рис.14. Свободнорадикальные реакции в процессе фагоцитоза
В результате деструкции белков и липидов как самих бактерий, так и тканей окружающих очаг воспаления, образуются продукты, обладающие антигенной и хемоатрактантной способностью. Эти вещества, в свою очередь, активируют фагоциты и усиливают их миграцию в очаг воспаления.
Установлено, что НАДФН-оксидазная активность усиливается лишь в результате контакта с плазматической мембраной, после поглощения и разрушения фагоцитированного объекта, стимулирующий эффект исчезает.
Следует отметить, что в случае незавершенного фагоцитоза, который характеризуется сохранением жизнеспособности объекта внутри фагосомы, повышенная продукция активных форм кислорода продолжается, что представляет реальную опасность как для самого фагоцита, так и для окружающих его клеток и тканей, так как АФК диффундируют в окружающую среду, следствием этого может быть некроз тканей в очаге воспаления с образованием полостей.
Таким образом, пока существует и действует чужеродный фактор, миграция и активация фагоцитов будет постоянно возрастать. Исходом может быть либо уничтожение этого чужеродного фактора, либо гибель организма вследствие подавления или истощения защитных сил. Сложность тактики врача заключается в том, чтобы коррегировать воспалительный процесс таким образом, чтобы ограничить некроз окружающих тканей и в то же время сохранить свободнорадикальную активность на уровне, достаточном для быстрого и полного уничтожения бактерий или других факторов, вызывающих воспалительный процесс.
СВОБОДНОРАДИКАЛЬНЫЙ МЕХАНИЗМ АНТИМИКРОБНОЙ ЗАЩИТЫ ГРУДНОГО МОЛОКА
Новорожденный ребенок с первых минут жизни вступает в контакт с микроорганизмами, находящимися в окружающей среде.
Собственная иммунная система новорожденных несовершенна, и до ее становления ребенок должен получать пассивную защиту oт болезнетворных бактерии с материнским молоком. Грудное молоко, таким образом, обеспечивает новорожденного не только энергетическим и пластическим материалом, витаминами и микроэлементами, необходимыми для нормального развития организма новорожденного, но и предохраняет его от болезнетворных бактерии.
Различают специфические и неспецифические факторы антимикробной защиты грудного молока. К специфическим относят иммуноглобулины. В грудном молоке особенно в первые дни лактации довольно значительно содержание иммуноглобулинов А и G. К неспецифическим факторам относят ксантиноксидазу, лактопероксидазу, лактоферрин, лизоцим, компоненты комплемента, а также клеточные элементы, обладающие фагоцитирующей активность и способностью вырабатывать бактерицидные вещества – нейтрофилы и макрофаги.Это деление сугубо условное, ибо не отражает истинного положения дел, т.к. все эти факторы объединяются для выполнения антимикробной функции в единую антимикробную систему.
Следует сразу оговориться, что речь идет не вообще об антимикробном действии грудного молока, а о целенаправленном уничтожении патогенных бактерий. Это необходимо отметить, потому что с первых минут контакта ребенка с окружающей средой начинается заселение кишечного тракта ребенка микроорганизмами, образующими, так называемую, нормофлору кишечника (кишечная палочка, лактобациллы и другие микроорганизмы, принимающие в дальнейшем активное участие в жизнедеятельности макроорганизма).
Избирательность антимикробного действия грудного молока, конечно, обеспечивается специфическими иммунными белками-лактоглобулинами. Благодаря наличию специфических антигенных детерминант, лактоглобулины связывают патогенные бактерии, образуя иммунные комплексы. Иммунные комплексы, по-видимому, сами обладают способностью связывать ксантиноксидазу, лактопероксидазу и другие неспецифические факторы, либо подобная система образуется на поверхности фагоцитирующих клеток, благодаря наличию соответствущих рецепторов.
Именно эта система и обеспечивает единое актимикробное действие. Механизм заключается в том, что ксантиноксидаза окисляет ксантин, либо гипоксантин и образует супероксидный анион-радикал - ведущую активную форму кислорода в процессах свободнорадикального окисления.
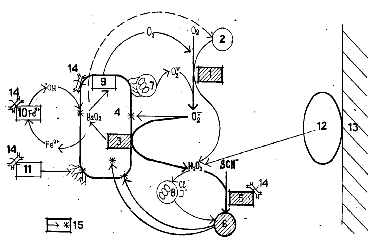
Рис.15. Взаимодействие основных факторов антимикробной защиты грудного молока при контакте с патогенной флорой: 1-ксантиноксидаза, 2-ксенобиотик , 3-периплазматическая супероксиддисмутаза, 4-бактериальная стенка, 5- лактопероксидаза, 6-гипохлорит ионы и окситиоцианат-ионы, 7- НАДФН-оксидаза, 8-миелопероксидаза, 9 –бактериальная каталаза, 10-лактоферрин, 11- лизоцим,12 – лактобактерия, 14-sIgA –иммуноглобулинмолока, 15-Fe2+
Многие вирулентные бактерии в процессе эволюции выработали механизмы защиты от бактерицидных факторов и в случае супероксидного анион-радикала действует бактериальная СОД, превращающая анион-радикал в перекись водорода. Этот момент, вероятно, является кульминационным в борьбе микро- и макроорганизма. Нейтрализуя супероксидный анион-радикал путем образования перекиси водорода, патогенные вирулентные бактерии вызывают еще больший огонь на себя, запуская в действие лактопероксидазу, для которых перекись водорода является необходимым субстратом. Используя перекись водорода, лактопероксидаза образует тиоционат-ионы способные подобно гипохлорит-ионам разрушать белковые молекулы. Лактоферрин освобождает двухвалентное железо и катализируетраспад перекиси водорода с образованием гидроксильного радикала, атакующего жирные кислоты бактериальных липидов. Благодаря сочетанному действию этих и других факторов (лизоцим разрушает полисахариды клеточной бактериальной стенки) важнейшие структуры бактериальных клеток подвергаются деструкции, что и приводит к гибели бактерии. Если эти процессы разыгрываются на поверхности нейтрофилов и макрофагов, последующее поглощение убитых бактерий завершается в фаголизосомах. Если же антибактериальные факторы действуют только в комплексе с иммуноглобулинами, убитые бактерии, уже не представляющие опасности для организма ребенка, просто выводятся.
Литература
1. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах.М., «Наука», 1972.-252 с.
2. Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский образоватедльный журнал.-2000.-№12.- С.13-19
3. Граник В.Г., Григорьев Н.Б. Оксид азота. – М.: Вузовская книга, 2004.-360 с.
4. Зенков Н.К., Меньщикова Е.Б., Шергин С.М. Окислительный стресс: диагностика, терапия, профилактика. Новосибирск, РАМН, Сибирское отделение, 1993
5. Зенков Н.К., Ланкин В.З., МеньщиковаЕ.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М.: МАИК «Наука/Интерпериодика», 2001
6. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях.М.: РКНПК.-2001.-78 с.
7. Меньщикова Е.Б., Зенков Н.К., Шергин С.М. Биохимия окислительного стресса: оксиданты и антиоксиданты. Новосибирск, СО РАМН, 1994
8. Меньщикова Е.Б. и др. Окислительный стресс. Прооксиданты и антиоксиданты. /Е.Б.Меньщикова, В.З.Ланкин, Н.К.Зенков , И.А.Бондарь, Н.Ф.Круговых, В.А.Труфакин.-М.: Фирма «Слово», 2006, -556 с.
9. Меньщикова Е. Б.Окислительный стресс: Патологические состояния и заболевания / Е. Б. Меньщикова, Н. К. Зенков, В. З. Ланкин, И. А. Бондарь, В. А. Труфакин. — Новосибирск:АРТА, 2008. — 284 с.
СОДЕРЖАНИЕ
| Список сокращений | ||
| 1. | Введение | |
| Ферментативные пути образования активных форм кислорода | ||
| Микросомальные монооксигеназы | ||
| Ксантиноксидоредуктаза | ||
| НАДФ-оксидаза | ||
| NO-синтаза | ||
| Миелопероксидаза | ||
| Перекисное окисление липидов | ||
| Стадии перекисного окисления липидов | ||
| Развитие цепи | ||
| Обрыв цепи | ||
| Разрушение структуры окисленных липидов | ||
| Повреждение клеток в результатеперекисного окисления липидов | ||
| Механизм повреждающего действия продуктов ПОЛ | ||
| Повышение проницаемости | ||
| Образование комплексов | ||
| Окисление аминокислот и белков, содержащих сульфгидрильные группы | ||
| Перекисная гипотеза гибели клеток. Системы антиоксидантной защиты. Роль ПОЛ в норме и при патологии. | ||
| Антиоксидантная система организма | ||
| Антиоксиданты неферментативной природы | ||
| Витамин Е – α-токоферол | ||
| Витамин С (аскорбиновая кислота) | ||
| β-каротин | ||
| Коэнзим Q - убихинон | ||
| Хелаторы ионов металлов переменной валентности | ||
| Церулопалазмин | ||
| Металлотионеины (МТ) | ||
| «Ловушки»гидроксильных радикалов | ||
| Гормоны - антиоксиданты | ||
| Ферментные системы антиоксидантной защиты | ||
| Супероксиддисмутаза | ||
| Каталаза | ||
| Глютатионпероксидазная система | ||
| Глютатион-S-трансферазная система | ||
| Структурный антиоксидантный фактор | ||
| Простагландины | ||
| Простациклин (ПГ I2) | ||
| Лейкотриены | ||
| Свободнорадикальное окисление, фагоцитоз и воспаление | ||
| Свободнорадикальный механизм антимикробной защиты грудного молока |
Печать цифровая. Бумага офсетная. Гарнитура «Таймс».
Формат 60х84/16. Объем 1.9 уч.-изд.-л.
Заказ № 3120. Тираж 250 экз.
Отпечатано в КМЦ «КОПИЦЕНТР»
344006, г. Ростов-на-Дону, ул. Суворова, 19, тел. 247-34-88
| <== предыдущая страница | | | следующая страница ==> |
| Церулоплазмин (ЦП) | | | Холодный цех |
Дата добавления: 2014-10-17; просмотров: 1821; Нарушение авторских прав

Мы поможем в написании ваших работ!