
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Термические параметры состояния. Уравнение состояния
Термодинамическая система в любой момент времени может быть охарактеризована рядом величин, которые могут изменяться в зависимости от состояния самой системы. Эти величины называются термодинамическими параметрами состояния.
В авиационных двигателях процесс превращения теплоты в работу происходит с помощью газообразного рабочего тела.
Из курса физики известно, что состояние газа можно полностью определить с помощью трех основных параметров: абсолютного давления, удельного объема и абсолютной температуры.
Абсолютное давление.
Абсолютное давление газа (р) - представляет собой средний результат силового воздействия молекул на стенки сосуда и равно отношению нормальной составляющей силы (F) к площади (s), на которую действует сила, то есть
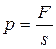
В международной системе единиц (СИ) абсолютное давление измеряется в паскалях (Па).
1 Н/м2 = 1 Па = 10-3 кПа = 10-6 МПа.
В расчетах нередко встречается внесистемная единица – бар.
1 бар=105Па=100 кПа=0,1 МПа.
Применяемые в технике приборы для измерения давления (манометры, вакуумметры) фиксируют разность между абсолютным давлением (рабс) в месте измерения давления и внешним атмосферным (барометрическим) давлением (рбар).
Манометры применяется для измерении давления в сосуде, превышающего атмосферное.
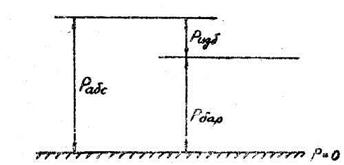
Рис. I.3 К измерению давления манометрами.
Разность между абсолютным давлением (рабс) и атмосферным (рбар). носит название избыточного давления (ризб).
ризб= рабс - рбар или
рабс = рбар + ризб
Если в сосуде давление меньше атмосферного, то имеет место разрежение (вакуум). Разность между барометрическим и абсолютным давлением в этом случае называется вакуумом или разрежением.
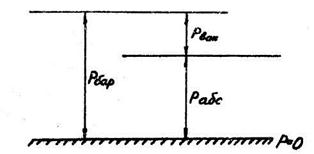
Рис. 1.4 К измерению давления вакуумметрами.
рвак= рбар- рабс или
рабс = рбар- рвак .
Абсолютная температура
Согласно молекулярно-кинетической теории газов, абсолютная температура (Т) является мерой интенсивности теплового движения молекул газа и определяется средней кинетической анергией движения молекул.
Измерить непосредственно кинетическую энергию движения молекул газа практически невозможно, поэтому для измерения температуры используют зависимость от температуры какого-либо из свойств вещества (теплового расширения, электродвижущей силы между металлами термопары, электросопротивления и др.).
Числовое значение измеренной температуры зависит от выбранной шкалы температуры. Наиболее универсальной шкалой температур, не зависящей от каких-либо свойств вещества, является абсолютная термодинамическая шкала температур - шкала Кельвина, построенная на основании второго закона термодинамики.
В абсолютной шкале температур (шкала Кельвина) для единственной экспериментальной реперной точки - температуры тройной точки воды - принято значение 273,16 (точно).
(Тройная точка воды - это состояние, при котором находятся в состоянии равновесия, все три фазы воды: твердая - лед, жидкая - вода, газообразная - водяной пар).
Единицей измерения температуры по абсолютной шкале температур является кельвин, равный 1/ 273,16 части интервала от абсолютного нуля температуры до температуры тройной воды. Температура по шкале Кельвина обозначается – Т[К].
Широкое распространение имеет международная практическая температурная шкала (МПШ) - шкала Цельсия. За нулевую точку отсчета в МПШ принимается температура таяния льда при нормальных физических условиях. Температура кипения воды при нормальных физических условиях придается значение 100 градусов. За единицу измерения принят градус Цельсия. Температура по шкале Цельсия обозначается –t [0С].
Абсолютная температура (Т) и температура по шкале Цельсия (t) связаны между собой зависимостью:
Т[K] = t [0С]+ 273,16,
т.к. температура таяния льда по абсолютной шкале температур равна 273,16 К.
Абсолютная величина одного кельвина и одного градуса Цельсия равны между собой, так как в основу обеих шкал температур положены физические свойства воды.
Удельный объем.
Удельным объемом называется объем массы рабочего тела:
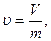
где 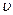 - удельный объем, м3/кг;
- удельный объем, м3/кг;
V – объем рабочего тела, м3;
m – масса рабочего тела, кг.
Параметром рабочего тела может являться и его плотность, представляющая собой массу рабочего тела, заключенную в единице объема:
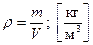 .
.
Плотность и удельный объем связаны обратно пропорциональной зависимостью:
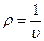 или
или 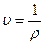
Уравнение состояния.
Основные термодинамические параметры состояния рабочего тела: абсолютное давление (р), абсолютная температура (Т), удельный объем ( 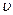 ) однородных тел имеют функциональную зависимость между собой. В общем виде эта зависимость записывается следующим образом:
) однородных тел имеют функциональную зависимость между собой. В общем виде эта зависимость записывается следующим образом:
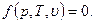
Это выражение носит название - уравнение состояния. Оно справедливо только для равновесного состояния рабочего тела.
Существование такой однозначной зависимости объясняется тем, что параметры 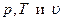 определяются одними и теми же величинами: скоростью движения молекул и расстоянием между ними, которые для конкретного состояния имеют определенное значение.
определяются одними и теми же величинами: скоростью движения молекул и расстоянием между ними, которые для конкретного состояния имеют определенное значение.
Для большинства реальных веществ аналитическая зависимость между параметрами состояния очень сложна и может быть получена только на основании экспериментальных данных.
Наиболее простым уравнением состояния является уравнение состояния для одного килограмма идеального газа – уравнение Клайперона:
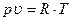
Для массы рабочего тела, не равной I кг, применяется уравнение состояния Клайперона - Менделеева:
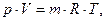
в котором
р- абсолютное давление газа, Па;
V - полный объем рабочего тела, м3;
m - масса рабочего тела, кг;
Т - абсолютная температура рабочего, К;
R- газовая постоянная рабочего тела, Дж/кг К.
Физический смысл газовой постоянной.
Газовая постоянная рабочего тела (R) - это работа, которую совершает 1 кг рабочего тела при изменении его температуры на один кельвин при постоянном давлении. Величина этой работы зависит от физических свойств рабочего тела, поэтому для каждого реального газа газовая постоянная имеет свое значение.
Между газовой постоянной и универсальной газовой постоянной имеется взаимосвязь:
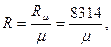
где 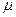 - молекулярная масса газа, кг/ кмоль.
- молекулярная масса газа, кг/ кмоль.
Из уравнения состояния видно, что для того, чтобы узнать все термодинамические параметры состояния газа, необходимо знать два из трехосновных параметров состояния, следовательно, состояние рабочего тела можно изобразить графически в плоской системе координат. Принято изображать в«р -  » координатах.
» координатах.
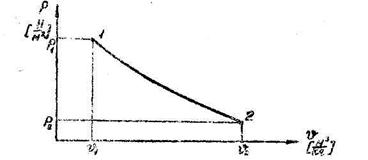
Рис. 1.5. Изображение термодинамического процесса в « р- 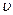 » координатах.
» координатах.
Для каждой точки термодинамического процесса, изображенного в «р- 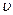 » координатах, известны абсолютное давление и удельный объем. Абсолютную температуру рабочего тела в каждой точке можно определить с помощью уравнения состояния.
» координатах, известны абсолютное давление и удельный объем. Абсолютную температуру рабочего тела в каждой точке можно определить с помощью уравнения состояния.
| <== предыдущая страница | | | следующая страница ==> |
| Общие мероприятия по охране природы при строительстве и эксплуатации скважин | | | Аналитические выражения для работы и теплоты в процессе Теплоемкость |
Дата добавления: 2014-10-28; просмотров: 526; Нарушение авторских прав

Мы поможем в написании ваших работ!