
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ТЕПЛОВАЯ ТЕОРЕМА НЕРНСТА
Сопоставление тепловых эффектов и изменения энергии Гиббса в реакциях, происходящих в конденсированных системах при различных температурах, показывает, что в области низких температур при приближении к абсолютному нулю значения тепловых эффектов и изменения энергии Гиббса сближаются. Тепловая теорема является постулатом, утверждающим, что это сближение продолжается и при дальнейшем понижении температуры, причем при абсолютном нуле и вблизи него кривые соприкасаются и общая для них касательная параллельна оси температур.
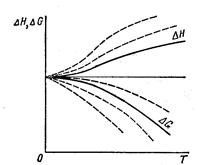
Математически ΔG = ΔH
lim│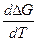 │T→0 = lim│
│T→0 = lim│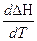 │T→0 = 0
│T→0 = 0
Из тепловой теоремы вытекает ряд следствий
(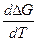 )p = -ΔS при Т → 0
)p = -ΔS при Т → 0
lim[ΔS]T→0 = 0 [ΔS]T=0 = 0
т.е. вблизи абсолютного нуля все реакции, совершающиеся в конденсированных системах ,не сопровождаются изменением энтропии.
Второе следствие получим, применяя условие
(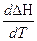 )p = ΔC
)p = ΔC
lim[ΔC]T→0 = 0 [ΔC]T=0 = 0
т.е. вблизи абсолютного нуля изменение теплоемкости твердых реагирующих веществ бесконечно мало отличается от нуля. Можно показать, что при очень низких температурах не только ΔS и ΔС твердых тел стремятся к нулю, но и многие другие свойства тел (объем, давление насыщенного пара и др.) изменяются с температурой так, что их производные по температуре стремятся к нулю. Этим объясняется принцип недостижимости абсолютного нуля (называемый также третьим законом термодинамики),согласно которому никакие процессы не могут снизить температуру до абсолютного нуля.
1.24 РАСЧЕТ ХИМИЧЕСКОГО РАВНОВЕСИЯ С ПОМОЩЬЮ
СТАНДАРТНЫХТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН
В настоящее время известны стандартные теплоты образования и энтропии более 7500 простых веществ и соединений. С помощью этих табличных данных можно вычислить термодинамические параметры многих десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально. В методе расчета, основанном на использовании стандартных термодинамических величин, используются два исходных уравнения
ΔG0T = ΔH0T – TΔS0T
lnK0P = - ΔG0T /RT
Если нет никаких предварительных сведений о положении равновесия при интересующей нас температуре, расчет ΔG и Кр полезно производить в две стадии. В первой стадии вычисляют изменение энергии Гиббса при Т = 298К и для стандартных условий.
Для расчета ΔН0298 и ΔS0298 используют уравнения
ΔH0298 = (nΔH0298,f)кон - (nΔH0298f)нач
ΔS0298 = (nS0298)кон - (nS0298)нач
По величине и знаку  ΔG0298 судят о возможности получения желаемых веществ из взятых исходных в стандартных условиях.
ΔG0298 судят о возможности получения желаемых веществ из взятых исходных в стандартных условиях.
Не следует думать, что реакция неосуществима вообще, если по расчету получится сравнительно небольшая величина ΔG0298.Реакция невозможна только в стандартных условиях, но, вероятно, может протекать при иных температурах и давлении, при непрерывном удалении продуктов реакции из зоны реакции.
Точный расчет (вторая стадия) покажет - при каком сочетании указанных факторов величина энергии Гиббса станет отрицательной и как она должна быть изменена дальше, чтобы выход продуктов реакции сделался достаточно большим. В качестве ориентировочного критерия, определяющего целесообразность второго этапа расчетов, рекомендуется величина ΔG0298 = 418кдж/моль
На второй стадии расчета переходят от значения ΔG0298 к значению ΔG0т при других температурах.
Для этого необходимо вычислить ΔH0т и ΔS0т при заданной Т.
ΔH0т = ΔН0298 + 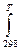 ΔСрdT
ΔСрdT
ΔS0т = ΔS0298 + 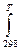 ΔСр
ΔСр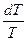
ΔG0т = ΔH0298 – TΔS0298 + 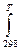 ΔCpdT - T
ΔCpdT - T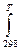 ΔCp
ΔCp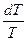
Если пренебречь влиянием изменения теплоемкости, т. е. ΔСр = 0,то решение уравнения будет грубо приближенным
ΔG0т = ΔH0298 – TΔS0298
Данное приближение (первое приближение Улиха) необходимо для быстрой оценки возможности протекания реакции при интересующей температуре.
При выполнении точного расчета подставляется зависимость
ΔСр = f(T) ΔCр = Δа + ΔвТ + ΔсТ2 + Δс1 Т-2
Проведя интегрирование, получим
ΔG0 т = ΔH0298 – TΔS 0298 - T{Δa(ln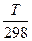 +
+ 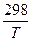 - 1) +
- 1) +
+ 
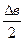 (T - 2×298 +
(T - 2×298 + 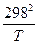 ) +
) + 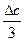 (Т2 - 3×2982 +
(Т2 - 3×2982 + 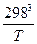 ) - Dс1(-
) - Dс1(-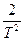
+ 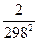 +
+ 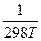 )}.
)}.
DG0T = DH0298 - T×DS0298 – T(DaM0 + DbM1 + DcM2 + Dc1M-2.
Коэффициенты М0 ,М1 ,М2 , М-2 рассчитаны для разных температур, их значения можно найти в справочнике.
Этот метод расчета называется методом Темкина – Шварцмана.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ ОТ ДАВЛЕНИЯ | | | УСЛОВИЯ ФАЗОВОГО РАВНОВЕСИЯ |
Дата добавления: 2014-03-11; просмотров: 538; Нарушение авторских прав

Мы поможем в написании ваших работ!