
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Катион слабого основания Анион слабой кислоты
2. Составить сокращенное молекулярно-ионное уравнение гидролиза по катиону или аниону слабого электролита
Al3++HOH«AlOH2++Н+ PO3–4+HOH«HPO3–4+OH–
При обычных условиях (без нагревания и разбавления) гидролиз идет по первой ступени с одной молекулой воды на один ион соли.
3. Определить реакцию среды.
Катионы водорода H+ – среда кислая. Анионы гидроксид-иона OН- - среда щелочная.
Al3++HOH«AlOH2++Н+ PO3-4+HOH«HPO3-4+OH-
Кислая среда рН<7 щелочная среда РН>7
4. Составить молекулярное уравнение гидролиза, ориентируясь на ионы, образующиеся при гидролизе катиона или аниона.
При гидролизе по катиону промежуточным продуктом является основная соль.
AlCl3+HOH«AlOH2+Cl–2+HCl
При гидролизе по аниону промежуточным продуктом является кислая соль.
Na2PO4+HOH«Na+HPO3–4+NaOH.
Гидролизу подвергаются соли:
1. образованные слабой кислотой и сильным основанием.
Гидролизу подвергается анион соли, и реакция сопровождается образованием ионов ОН–, раствор имеет щелочную среду (рН>7)
Уравнение гидролиза имеет вид:
В ионной форме:
KCN«K++CN–
CN–+HOH«HCN+OH–
В молекулярной форме:
KCN+H2O«HCN+KOH
2. Соль, образованная сильной кислотой и слабым основанием, например, ZnCl2. Соль гидролизуется по катиону и сообщает раствору кислую среду (pH<7).
В ионной форме:
ZnCl2«Zn2++2Cl–
1. Zn2++HOH«ZnOH++H+
2. ZnOH++HOH«Zn(OH)2+H+
В молекулярной форме:
1. ZnCl2+H2O«ZnOHCl+HCl
2. ZnOHCl+H2O«Zn(OH)2+HCl.
Гидролиз таких солей идет ступенчато и в основном, при комнатной температуре по 1 ступени.
3. Соль образованная слабой кислотой и слабым основанием, CH3COONH4.
Ионы такой соли одновременно связывают ионы Н+ и ОН–, смещая равновесие диссоциации воды:
В ионном виде:
CH3COONH4«СH3COO–+NH4+
СH3COO–+NH4++HOH«CH3COOH+NH4OH
В молекулярном виде:
CH3COONH4+H2O« CH3COOH+NH4OH
Степень диссоциации CH3COOH и NH4OH одинаковы, то раствор соли будет нейтральным, рН = 7.
4. Соль, образованная сильной кислотой и слабым основанием, гидролизу не подвергается: NaCl, KCl, NaNO3, Na2SO4, CaSO4, Ca(NO3)2, и др.
5. Соль, образованная катионом слабого основания и анионом слабой кислоты, взаимодействует с водой с образованием конечных продуктов основанием и кислотой, которые уходят из сферы реакции.
Al2S3+6HOH=Al(OH)3¯+H2S
12.2 Количественные характеристики гидролиза.
Гидролизу подвергается не вся соль, а лишь её часть, т.е. в растворе устанавливается равновесие между солью и образующими её кислотой и основанием. Поэтому часть вещества, подвергающаяся гидролизу, характеризуется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли, а также от её природы. Природа соли проявляется в величине константы гидролиза соли.
Константа гидролиза соли Кг характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени протекает гидролиз (при постоянстве Т и концентрации соли).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием, равна:
Кг= 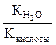 , где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
, где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
Константа гидролиза соли, образованной сильной кислотой и слабым основанием, равна:
Кг= 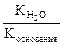 , где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
, где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
Константа гидролиза соли, образованной слабой кислотой и слабым основанием, равна:
Кг= 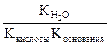 .
.
12.3.Управление процессом гидролиза

Гидролиз - обратимый процесс.
Гидролитическое
равновесие можно смещать
с помощью нескольких факторов
 |
12.4. Контрольные задания
221.Написать уравнение гидролиза следующих солей: К2S MgCl2. Дать характеристику pH водного раствора данных солей: вычислить константу гидролиза.
222.Написать уравнение гидролиза в ионном виде, дать характеристику pH водного раствора соли AlCl3 .
223.Написать уравнение гидролиза в ионном виде, дать характеристику pH водного раствора солей NH4NO2,Na2SO3 .Вычислить константу гидролиза.
224.Какие из солей подвергаются гидролизу: Li2SO4, CuCl2, KNO3 . Для гидролизующихся солей написать уравнение гидролиза в ионном виде; дать характеристику pH водного раствора солей; вычислить константу гидролиза.
225.Написать уравнение гидролиза в ионном виде, дать характеристику pH водного раствора соли CrCl3 .Вычислить константу гидролиза данной соли
226.Дать характеристику pH водного раствора солей; K2S , Mg(CN)2 , Al2(SO4)3, CuCl2. Написать уравнение гидролиза в ионном виде соли Mg(CN)2,вычислить константу гидролиза.
227.Написать уравнение гидролиза в ионном и молекулярном виде соли CrCl3; вычислить константу гидролиза данной соли
228.Какие из перечисленных солей будут подвергаться гидролизу: NaCN, KNO3, Ca(HCO3)2, HCOOK, BaCl2. Для гидролизующихся солей написать уравнения гидролиза в ионном виде.
229.Написать уравнение гидролиза следующих солей; FeSO4, Na3PO4 , NaClO . Дать характеристику pH водного раствора соли, вычислить константу гидролиза.
230.Написать уравнение гидролиза дать характеристику pH водного раствора соли: ZnBr2 ; вычислить константу гидролиза.
231.Написать уравнение гидролиза следующих солей в ионном виде; Cr2(SO4)3, CuSO4, NaNO2. Дать характеристику pH водного раствора данных солей. Вычислить константу гидролиза.
232.Написать уравнение гидролиза в ионном виде соли CuCl2 ; Дать характеристику pH водного раствора. Вычислить константу гидролиза .
233.Написать уравнение гидролиза в ионном виде соли NiSO4, FeCl2, Na2SO3 . Дать характеристику pH водного раствора данных солей. Вычислить константу гидролиза соли FeCl2 .
234.Какие из солей подвергаются гидролизу KJ, Na3PO4, LiNO3, Pb(NO3)2. Написать уравнение гидролиза в ионном виде для данных солей. Вычислить константу гидролиза для Pb(NO3)2.
235.Написать уравнение гидролиза в ионном виде для соли K3AsO4 . Дать характеристику pH водного раствора. Вычислить константу гидролиза.
236.Какие из солей подвергаются гидролизу KJ, Na3PO4. Написать уравнение гидролиза в ионном виде. Вычислить константу гидролиза 237.Какие из солей подвергаются гидролизу LiNO3, Pb(NO3)2. Написать уравнение гидролиза в ионном Вычислить константу гидролиза.
248. Написать уравнение гидролиза в ионном виде для CuCl2.. Вычислить константу гидролиза.
239. Написать уравнение гидролиза в ионном виде для NaCN. Вычислить константу гидролиза.
240. Написать уравнение гидролиза в ионном виде для HCOOK. Вычислить константу гидролиза.
| <== предыдущая страница | | | следующая страница ==> |
| ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ РЕАКЦИЙ ОБМЕНА | | | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ |
Дата добавления: 2014-09-08; просмотров: 701; Нарушение авторских прав

Мы поможем в написании ваших работ!