
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Распределение Максвелла
При рассмотрении давления и выводе формулы для давления на основании представлений о газе, как о совокупности движущихся хаотическим образом частиц мы ввели понятие средней скорости и предположили, что все частицы имеют одинаковую скорость. Это предположение верно для упрощенной модели, пригодной для вывода уравнения состояния. Реально из-за соударения молекул (атомов) друг с другом и со стенками сосуда, всегда имеются молекулы (атомы) с относительно малыми скоростями и молекулы (атомы) с повышенными скоростями.
Один из важнейших вопросов физики заключается в том, каким будет распределение частиц по скоростям (то есть какое число частиц будет иметь скорость в интервале от 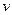 до
до 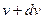 ). Этот вопрос был изучен английским физиком Максвеллом, и найденная им зависимость получила название распределения Максвелла.
). Этот вопрос был изучен английским физиком Максвеллом, и найденная им зависимость получила название распределения Максвелла.
Пусть dN – число частиц, скорости которых лежат в интервале от 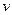 до
до 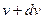 . Очевидно, что dN будет увеличиваться с ростом интервала
. Очевидно, что dN будет увеличиваться с ростом интервала 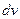 . Т.е.
. Т.е. 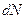 ~
~ 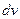 . В то же время dN будет увеличиваться, чем больше общее число частиц N. Т.о.
. В то же время dN будет увеличиваться, чем больше общее число частиц N. Т.о. 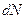 ~
~ 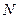 . Отсюда
. Отсюда 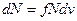 , где
, где 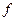 - коэффициент пропорциональности. Число
- коэффициент пропорциональности. Число 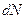 будет зависеть от того, где будем брать интервал скоростей, поэтому
будет зависеть от того, где будем брать интервал скоростей, поэтому 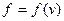 . Получаем
. Получаем 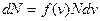 .
.
Разделим обе части равенства на 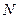 :
: 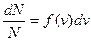 , но
, но 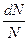 - это вероятность того, что модуль скорости молекулы окажется в пределах от
- это вероятность того, что модуль скорости молекулы окажется в пределах от 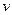 до
до 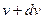 . Отсюда
. Отсюда 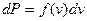 или
или 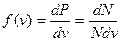 - это плотность вероятности (т.е. вероятность, приходящаяся на единичный интервал скоростей, или вероятность того, что частица будет иметь заданную скорость в единичном интервале скоростей).
- это плотность вероятности (т.е. вероятность, приходящаяся на единичный интервал скоростей, или вероятность того, что частица будет иметь заданную скорость в единичном интервале скоростей).
Максвелл нашел вид функции 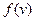 . Строгое доказательство громоздко, запишем готовый результат:
. Строгое доказательство громоздко, запишем готовый результат: 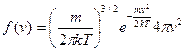 (1).
(1).
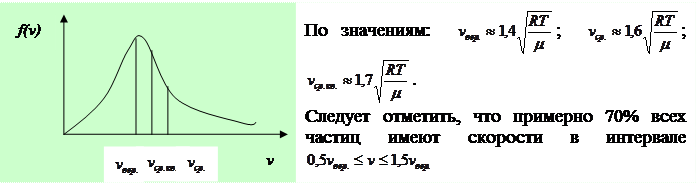
Эту функцию называют функцией распределения молекул газа по скоростям.Графически эта функция выглядит следующим образом: 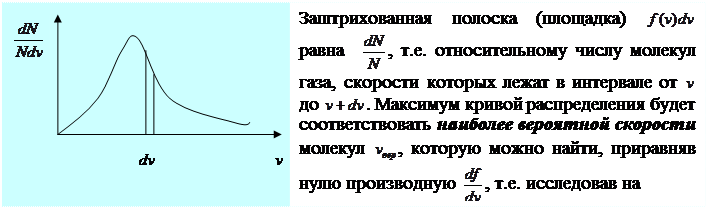 исследовав на экстремум функцию (1). Опустив в выражении (1) постоянные множители
исследовав на экстремум функцию (1). Опустив в выражении (1) постоянные множители 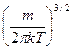 и
и 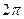 , получим для нахождения
, получим для нахождения 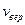 :
: 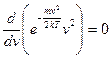 .
.
После дифференцирования имеем: 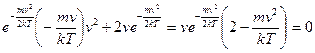 . Удовлетворяющие этому уравнению значения
. Удовлетворяющие этому уравнению значения 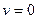 и
и 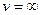 соответствуют минимуму функции (смотреть график). Отсюда, значение
соответствуют минимуму функции (смотреть график). Отсюда, значение 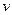 , отвечающее максимуму, будет:
, отвечающее максимуму, будет: 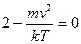 , т.е.
, т.е. 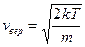 или
или 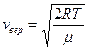 .
.
Средняя скорость молекул определяется как 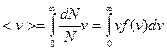 , где
, где 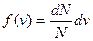 . Интеграл берут по частям и получают
. Интеграл берут по частям и получают 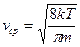 или
или 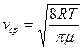 . Эту скорость называют средней арифметической скоростью.
. Эту скорость называют средней арифметической скоростью.
Средняя квадратичная скорость определяется как 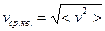 (из
(из 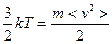 ;
; 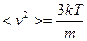 ). Отсюда
). Отсюда 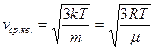 .
.
Из полученных формул видно, что 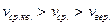 На графике:
На графике:
Используя распределение молекул идеального газа по скоростям, т.е. 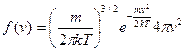 , имеем
, имеем 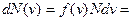
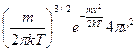
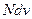 . Найдем распределение по энергиям.
. Найдем распределение по энергиям.
Так как молекулы газа обладают кинетической энергией 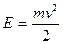 , то
, то 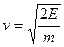 и
и 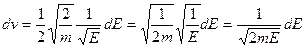 . Перейдя от переменной
. Перейдя от переменной 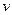 к
к 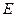 , получим
, получим
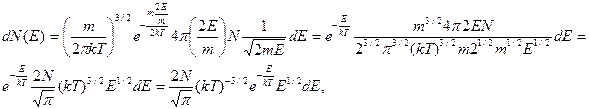
где 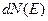 - число молекул, имеющих кинетическую энергию от
- число молекул, имеющих кинетическую энергию от 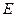 до
до 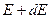 .
.
Функция распределения молекул по энергиям имеет вид:
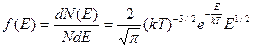 .
.
Средняя кинетическая энергия молекулы идеального газа определяется интегралом: 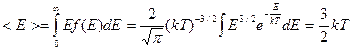 .
.
Впервые закон Максвелла о распределении молекул по скоростям и энергиям был экспериментально подтвержден в опытах Штерна. Опыт состоял в следующем: брали платиновую нить, покрытую серебром, ее помещали в цилиндр (при этом нить располагали по оси цилиндра, в цилиндре есть узкая щель), все заключали в другой цилиндр. При нагревании проволоки током серебро испаряется, атомы вылетают через щель и попадают на внутреннюю поверхность цилиндра. Если оба цилиндра неподвижны, то все атомы серебра попадают в одну и ту же точку, независимо от их скорости. При одновременном вращении обоих цилиндров с угловой скоростью ω атомы серебра (в зависимости от скорости) попадают в другую точку на стенке цилиндра, так как за время полета от точки О до стенки цилиндр успевает повернуться.

| <== предыдущая страница | | | следующая страница ==> |
| Статистические распределения | | | Распределение Больцмана |
Дата добавления: 2014-11-08; просмотров: 558; Нарушение авторских прав

Мы поможем в написании ваших работ!