
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
РЕКОМБИНАЦИЯ У E. COLI: ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ И МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ
Ко второму типу наследственной изменчивости относятся изменения, возникающие у прокариот в результате рекомбинации генетического материала, при которой происходит частичное объединение геномов двух клеток. Известны три основных способа, приводящих к рекомбинации генетического материала прокариот, различающихся механизмами передачи хромосомной ДНК, заменяющих им половой:
1. конъюгации
2. трансдукции
3. трансформация.
При конъюгации клетки разных половых типов вступают в контакт, и из клетки донора в клетку реципиента передается одна из двух цепей кольцевой ДНК (хромосомы или конъюгативной плазмиды, если последняя не интегрирована в хромосоме). При этом конъюгирующие пары бактериальных клеток постепенно расходятся из-за непрочной связи между ними, и перенос ДНК сразу прекращается. Поэтому реципиентные клетки никогда не получают от донора полную однонитевую кольцевую хромосомную ДНК, а только ее часть, которая сразу достраивается до линейного двуцепочечного фрагмента с так называемыми тупыми концами (у них нет выступающих одноцепочечных концов - "хвостов"). Размеры перенесенных фрагментов варьируют, чаще всего они достигают нескольких сот т.п.н.
Гены могут переноситься из одной бактериальной клетки в другую с помощью умеренных фагов. Такой перенос бактериальных генов получил название трансдукции. Трансдукция оказывается возможной, если в процессе размножения фага одна из частиц случайно захватит фрагмент бактериальной хромосомы, как правило, содержащий очень небольшое число генов. Когда такая фаговая частица заражает бактерию-реципиент, бактериальная ДНК проникает в клетку таким же путем, как фаговая. Между трансдуцированной бактериальной ДНК и гомологичным участком бактериальной хромосомы может произойти обмен, и как следствие его возникают рекомбинанты, несущие небольшую часть генетического материала клетки донора. Передача признаков с помощью фагов показана для бактерий, принадлежащих к разным родам. При трансдукции из клеток донора в клетку реципиента с помощью бактериофага (бактериального вируса) переносится двуцепочечный фрагмент бактериальной хромосомы, но в десятки раз меньшего размера, чем при конъюгации. Таким образом, с физической точки зрения генетический материал, передаваемый реципиентам при конъюгации и трансдукции, отличается только размерами. Далее донорный фрагмент должен заменить гомологичную часть хромосомы реципиента с помощью парных кроссинговеров, проходящих вблизи концов фрагмента.
Рассмотрим механизм самого кроссинговера у E. Coli (рис. 60). На начальной стадии исследований в лаборатории А. Кларка в США был выделен и изучен набор мутантов с нарушениями рекомбинации (у них была подавлена способность давать рекомбинантное потомство при конъюгации и трансдукции). С помощью этих мутантов, названных rec, были установлены соответствующие гены, а затем выделены рекомбинационные белки, инактивированные у мутантов.
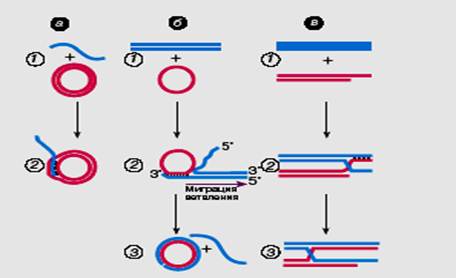
Рисунок 10. Три рекомбинационные реакции осуществляемые белком RecA. 1 (Глазер В.М. 1998).
Самый главный белок RecA - продукт гена recA. Белок имеет небольшой размер (всего около 38 кД) и проявляет разнообразную активность. Этот белок участвует не только в рекомбинации, но и в репарации ДНК. Мы рассмотрим только его роль в рекомбинации. В условиях in vitro для проявления всех активностей белка RecA требуются в качестве кофакторов АТФ и одноцепочечная ДНК в любой форме, например дуплексная ДНК с концевыми (хвосты) или внутренними (бреши) одноцепочечными участками. Основное назначение белка RecA - приводить во взаимодействие одноцепочечную ДНК с гомологичным дуплексом. В зависимости от структуры ДНК-субстратов белок может проводить разные рекомбинационные реакции. Прежде чем рассматривать эти реакции, отметим некоторые общие закономерности функционирования RecA-белка.
Важнейшее свойство белка RecA определяется наличием у него двух сайтов связывания с ДНК.
1. Первый сайт используется для первичного связывания с ДНК: в присутствии АТФ белок всегда взаимодействует в этом сайте с одноцепочечной ДНК. Связывание белка носит кооперативный характер, то есть его молекулы собираются на ДНК по принципу "конец-в-конец", образуя вокруг ДНК правозакрученную белковую спираль (не надо путать ее со спиралью самой ДНК). В результате возникает нитевидное образование - RecA-ДНК-филамент. Если одноцепочечная ДНК была в составе двуцепочечной молекулы (как хвост или брешь), то формирование филамента распространяется на дуплекс, что сопровождается гидролизом АТФ. В филаменте двуцепочечная ДНК изменяет свою конформацию. В отличие от обычной В-формы ДНК (где шаг спирали составляет 10,4 п.н.) на один виток спирали ДНК в филаменте приходятся 18,6 п.н., в результате чего ДНК оказывается растянутой в 1,5 раза. Считается, что такое растяжение дуплекса необходимо для его последующего взаимодействия с гомологичной одноцепочечной ДНК. Формирование филамента завершает подготовительную, пресинаптическую стадию кроссинговера.
2. Реакции, составляющие следующую, синаптическую стадию кроссинговера, происходят только внутри филаментов. При этом филаменты могут вступать в рекомбинацию только с "голой", не находящейся в филаменте ДНК. Два филамента не рекомбинируют друг с другом. Взаимодействие филамента с голой ДНК осуществляется за счет второго сайта связывания RecA. Связывание с ДНК во втором сайте слабое. Из-за этого между филаментом и «голой» ДНК возникают лишь кратковременные контакты (соударения). Эти контакты становятся прочными только после встречи гомологичных последовательностей.
Нахождение гомологии связано с формированием гетеродуплекса. Обычно оно начинается:
1. с образования структуры, в которой задействованы три цепи ДНК и которая называется D-петлей (от англ. displacement loop - петля вытеснения). Это происходит следующим образом:
· одноцепочечная ДНК внедряется в дуплекс (рис. 60, а)
· и образует двойную спираль (гетеродуплекс) с одной, комплементарной ей цепью дуплекса, одновременно вытесняя вторую цепь.
· D-петля может быть закрытой, если в дуплекс внедряется одноцепочечный хвост (рис. 60, а), или открытой, если она формируется на конце линейного дуплекса (рис. 60, б и в).
2. На следующем этапе - постсинапсисе гетеродуплекс удлиняется путем миграции ветвления, которую in vitro также может осуществлять белок RecA. В случае рекомбинации между одноцепочечной ДНК и дуплексом она происходит в определенном направлении, полярно, как показано на рис. 6, б. Эта полярность определяется активной (рекомбиногенной) ролью 3'-концевой одноцепочечной ДНК в реакции, катализируемой белком RecA. Миграция ветвления под действием RecA-белка сопровождается гидролизом АТФ, но происходит медленно, со скоростью несколько п.н./с. Таким образом, в условиях in vitro белок RecA способен осуществлять поиск гомологии, формировать синаптическую структуру на основе гетеродуплекса и производить обмен цепями между гомологами. Эти реакции стимулируются добавлением белка SSB, который выпрямляет одноцепочечную ДНК.
А теперь посмотрим, как осуществляется основной путь рекомбинации у E. coli - RecBCD. Главную роль здесь играет фермент RecBCD-нуклеаза, субъединицы которой кодируются генами recB, recC и recD. Фермент проявляет несколько активностей только в присутствии АТФ. RecBCD может гидролизовать одно- и двуцепочечную ДНК, притом с обоих концов, то есть работать как экзонуклеаза. Он имеет также хеликазную активность, то есть расплетает дуплекс ДНК, затрачивая на это энергию АТФ. Наконец, фермент работает как сайт-специфическая эндонуклеаза: расщепляет одноцепочечную ДНК около особой 8-нуклеотидной последовательности 5'-GCTGGTGG-3', называемой Chi-сайтом (рис. 61).
RecBCD-нуклеаза - один из самых ранних белков рекомбинации. Она готовит субстрат для белка RecA. Т.к. при конъюгации и трансдукции в реципиентной клетке оказывается линейный дуплекс донорной ДНК с тупыми концами, то такая ДНК необходима для рекомбинации с реципиентной хромосомой с участием RecBCD. Ниже приводится схема работы фермента:
· фермент атакует конец дуплекса и начинает расплетать его (рис. 61, а). Реакция асимметрична, что проявляется в особой роли цепи ДНК с 3'-концом. RecBCD удерживает его таким образом, что образуется одноцепочечная петля примерно в тысячу нуклеотидов длиной, тогда как 5'-цепь выступает в виде свободного хвоста. Продолжая расплетать дуплекс, RecBCD-нуклеаза сохраняет петлю в 3'-цепи и продвигает ее вдоль дуплекса.
· Поскольку после прохождения фермента комплементарные цепи ренатурируют ("схлопываются"), в 5'-цепи автоматически возникает вторая петля (рис. 61, б ).
· Двойная петля продвигается вдоль дуплекса до тех пор, пока фермент не встретит Chi-сайт в 3'-цепи. Фермент должен подойти к Chi-сайту справа, с 3'-стороны. На расстоянии 4-6 нуклеотидов до него RecBCD разрывает 3'-цепь (рис. 61, в) (вспомните о постулированных Холлидеем особых последовательностях ДНК, в которых происходят первичные разрывы цепей).
· Дальнейшее расплетание дуплекса приводит к вытеснению рекомбиногенного одноцепочечного 3'-конца (рис. 61, г, д ), который связывается с белком RecA.
· После этого происходит уже известная цепь событий. На 3'-конце сначала формируется филамент, затем образуется D-петля (закрытая, так как возникает в кольцевой хромосоме) (рис. 61, е).
· Затем D-петля разрезается с помощью одной из эндонуклеаз E. coli, что приводит к полухиазме Холлидея (рис. 61, ж).
· миграцию ветвления и разрешение полухиазмы осуществляют другие белки. Из них наиболее изучены RuvA, RuvB и RuvC - продукты генов ruvA, ruvB и ruvC. RuvA узнает крестообразную полухиазму и нацеливает на нее RuvB. Последний узнает комплекс RuvA-полухиазма и, используя энергию АТФ и работая как ДНК-хеликаза, осуществляет миграцию полухиазмы в том же направлении, что и RecA-белок in vitro, но гораздо эффективнее. Где-то здесь в игру вступает резолваза RuvC: она узнает комплекс RuvB-полухиазма, связывается с ним и в определенный момент разрешает полухиазму способом, описанным выше. На этом миграция полухиазмы прекращается.
· 5'-Концевая часть разорванной цепи ДНК, вероятно, удаляется несколько раньше (рис. 61, г) с помощью экзонуклеазной активности RecBCD. На этом участие белков RecA и RecBCD в рекомбинации, скорее всего, завершается. Далее ДНК-полимераза и ДНК-лигаза должны залечить брешь и разрывы в цепях (рис. 61, з).
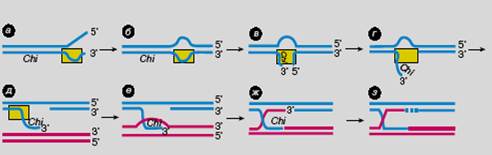
Рисунок 61. Схема рекомбинации с участием RecBCD-нуклеазы (Глазер В.М. 1998).
Инициация рекомбинации для простоты изображена только на одном конце фрагмента донорной ДНК. В действительности же вся описанная последовательность реакций происходит одновременно с обоих концов донорного фрагмента, что обеспечивает парность обменов при рекомбинации с хромосомой реципиента и исключает ситуацию, изображенную на рис. 1, в'. Перечисленные выше белки далеко не исчерпывают список участников кроссинговера у E. coli. Сюда входят также различные белки, помогающие RecA, белки, участвующие в альтернативных путях рекомбинации, и белки общего метаболизма ДНК: ДНК-гираза, ДНК-полимераза, ДНК-лигаза и группа белков, осуществляющих коррекцию неспаренных оснований в рекомбинационном гетеродуплексе.
| <== предыдущая страница | | | следующая страница ==> |
| МОДЕЛЬ ХОЛЛИДЕЯ | | | МОДЕЛЬ РЕКОМБИНАЦИИ НА ОСНОВЕ РЕПАРАЦИИ ДВУЦЕПОЧЕЧНЫХ РАЗРЫВОВ ДНК |
Дата добавления: 2014-11-08; просмотров: 606; Нарушение авторских прав

Мы поможем в написании ваших работ!