
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Уравнение Клапейрона–Клаузиуса
Ограничимся рассмотрением фазовых переходов первого рода, для которых характерно равенство изобарно-изотермических потенциалов двух фаз и скачкообразное изменение энтропии S и объёма V.
Будем рассматривать равновесие чистого вещества в двух фазах однокомпонентной системы (k = 1). Это могут быть следующие процессы:
а) Атв 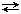 Аж – это процесс плавления (обратный процесс – кристаллизация);
Аж – это процесс плавления (обратный процесс – кристаллизация);
б) Аж 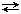 Агаз – процесс испарения (обратный процесс – конденсация);
Агаз – процесс испарения (обратный процесс – конденсация);
в) Атв 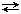 Агаз – процесс сублимации (возгонки), (обратный процесс – десублимация или конденсация);
Агаз – процесс сублимации (возгонки), (обратный процесс – десублимация или конденсация);
г) Атв,a 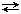 Атв,b – переход твердого тела из одной полиморфной (аллотропной) модификации в другую.
Атв,b – переход твердого тела из одной полиморфной (аллотропной) модификации в другую.
Для равновесия двух фаз (1) и (2) чистого вещества должны выполняться следующие условия:
р(1) = р(2); (1)
Т(1) = Т(2); (2)
m(1) = m(2); (3)
Из соотношения (3)получим, что dm(1) = dm(2) (4)
Но для чистого вещества химический потенциал m есть ни что иное, как молярная энергия Гиббса: 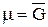 .
.
Поэтому 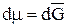 .
.
Но 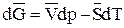 .
.
Для двух фаз (1) и (2) соотношение (4) примет вид:
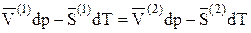 (5)
(5)
Перегруппируем члены:
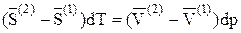 , откуда
, откуда
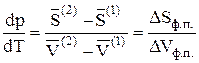 .
.
Таким образом, получаем:
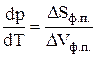 (6)
(6)
Соотношения (6) – это одна из форм записи уравнения Клапейрона-Клаузиуса.
Здесь DSф.п. – молярная энтропия фазового перехода (т.е. разность молярных энтропий вещества в двух фазах);
DVф.п. – разность молярных объемов вещества в двух фазах.
Если рассматривать обратимые изотермические фазовые переходы, то для них
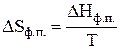 .
.
Тогда уравнения (6) можно переписать в следующем виде:
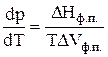 (7)
(7)
Соотношение (7) – это тоже уравнение Клапейрона–Клаузиуса. Здесь Т – температура фазового перехода, DНф.п . – молярная теплота (энтальпия)
фазового перехода. Величину 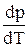 часто называют температурным коэффициентом давления насыщенного пара. Величина
часто называют температурным коэффициентом давления насыщенного пара. Величина 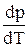 является угловым коэффициентом соответствующих кривых р = р(Т) (сублимации, испарения, плавления и полиморфных превращений).
является угловым коэффициентом соответствующих кривых р = р(Т) (сублимации, испарения, плавления и полиморфных превращений).
Рассмотрим вначале равновесия с участием пара.
а) твердое вещество  пар – возгонка (сублимация);
пар – возгонка (сублимация);
б) жидкость  пар – испарение (конденсация).
пар – испарение (конденсация).
Если рассматривать равновесия в области температур, далеких от критической, то можно записать:
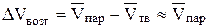 ;
;
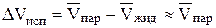 ,
,
поскольку объемом конденсированной фазы по сравнению с объемом пара можно пренебречь. Считая, что пар подчиняется законам идеальных газов
для 1 моль газа имеем:
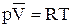 и
и 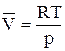 ,
,
тогда 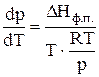
откуда следует, что 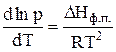 (8)
(8)
Соотношение (8)–дифференциальная форма уравнения Клапейрона-Клаузиуса для процессов возгонки или испарения.
Так как DHвозг > 0 и DHисп > 0, то lnp (а, значит, и р) – возрастающая функция, т.е. давление насыщенного пара над веществом увеличивается при увеличении температуры.
Разделим переменные в соотношении (8) Считаем, что в узком температурном интервале DHф.п. = const.
1) Возьмем неопределенный интеграл:
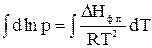
Отсюда:
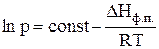 или
или 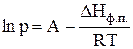 (9)
(9)
Уравнение прямой в координатах ln p-1/Т.
DНвозг > DНиспар,
Поэтому кривая возгонки р = р(Т) должна идти круче, чем кривая испарения. Если на одном графике изобразить зависимости в координатах lnp=f (  ), то будет наблюдаться следующая картина:
), то будет наблюдаться следующая картина:
Линия АВ - соответствует процессу испарения, а линия ВС - процессу возгонки.
2) Возьмем определенный интеграл:
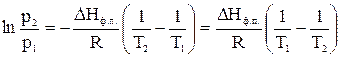 (10)
(10)
 |
Рассмотрим теперь процесс плавления:
Воспользуемся уравнением Клапейрона-Клаузиуса в виде:
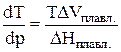 (11)
(11)
Здесь Т – температура плавления;
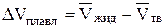 ; DНплавл – молярная теплота плавления.
; DНплавл – молярная теплота плавления.
Знак производной 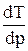 зависит от знака DVплавл. Обычно
зависит от знака DVплавл. Обычно 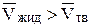 , поэтому
, поэтому
DVплавл > 0. Есть несколько исключений (например, вода, висмут, галлий для которых DVплавл < 0).
Температура фазового перехода между конденсированными фазами слабо зависит от давления р, поэтому соотношение (11) можно переписать в виде:
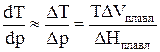
Пример 4.4Как изменится температура плавления льда с изменением внешнего давления, если ΔплН = 79,7 кал/г при t = 0 оС, а удельные объемы воды и льда при этой температуре равны соответственно: Vж = 1,0001 см3/г и Vлед = 1,0908 см3/г.
Решение.Воспользуемся уравнением Клаузиуса – Клапейрона в виде (4.16)
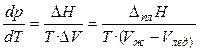 .
.
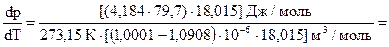
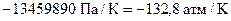 ,
,
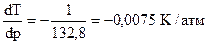 .
.
Пример 4.5Как изменится температура кипения воды с ростом давления, если при температуре t = 100 оС ΔиспН = 539,7 кал/г, Vпар = 1651 см3/г, Vж = 1 см3/г.
| <== предыдущая страница | | | следующая страница ==> |
| Правило фаз Гиббса | | | Решение. В отличие от температуры плавления, температура кипения очень сильно зависит от давления, что связано с большой величиной D |
Дата добавления: 2014-05-02; просмотров: 719; Нарушение авторских прав

Мы поможем в написании ваших работ!